
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сероводород. Получение, свойства
Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да, дигидросульфи́д) — бесцветный газ со сладковатым вкусом, имеющий запах протухших куриных яиц. Бинарное химическое соединение водорода и серы. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях взаимодействует со многими металлами. Огнеопасен. Концентрационные пределы воспламенения в смеси с воздухом составляют 4,5—45 % сероводорода. Используется в химической промышленности для синтеза некоторых соединений, получения элементарной серы, серной кислоты, сульфидов. Сероводород также используют в лечебных целях, например, в сероводородных ваннах[1].
Нахождение в природе
В природе встречается довольно редко в составе попутных нефтяных газов, природного газа, вулканических газах, в растворённом виде в природных водах (например, в Чёрном море слои воды, расположенные глубже 150—200 м содержат растворённый сероводород). Образуется при гниении белков, только тех, которые содержат в составе серосодержащие аминокислоты метионин и/или цистеин. Небольшое количество сероводорода содержится в кишечных газахчеловека и животных.
Физические свойства
Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет изогнутую форму, поэтому она полярна (μ = 0,34·10−29 Кл·м). В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота.
Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
 K a = 6,9·10−7 моль/л; p K a = 6,89.л
K a = 6,9·10−7 моль/л; p K a = 6,89.л
Реагирует со щелочами:
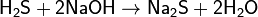 (средняя соль, при избытке NaOH)
(средняя соль, при избытке NaOH)
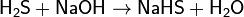 (кислая соль, при отношении 1:1)
(кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:
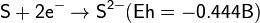

В воздухе горит синим пламенем:
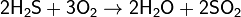
при недостатке кислорода:
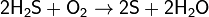 (на этой реакции основан промышленный способ получения серы).
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или ион SO42−, например:
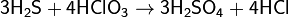
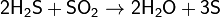
Качественной реакцией на сероводород, сероводородную кислоту и её соли является их взаимодействие с солями свинца, при котором образуется чёрный осадоксульфида свинца, например[2][ неавторитетный источник? 368 дней ]:

При пропускании сероводорода через человеческую кровь она чернеет, поскольку гемоглобин разрушается, и железо, входящее в его состав и придающее крови красный цвет, вступает в реакцию с сероводородом и образует чёрный сульфид железа[2].
|
|
Дата добавления: 2015-08-31; Просмотров: 1525; Нарушение авторских прав?; Мы поможем в написании вашей работы!