
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алюминий. Хар-ка. Соли их растворимость, гидролиз
|
|
|
|
Конец эл схемы всех Рэл-тов 3группы: ns2np1(c.o. +1), в возбужд состоянии: ns1np2(c.o. +3)
Конец эл схемы Al 3s23p1
Na2O∙Al2O3∙2SiO2, K2O∙Al2O3∙2SiO2 –алюмосиликаты
Al2O3∙nH2O-бокситы, Al2O3-коррунд, Na3[AlF6]-криолит
Легкий Ме, высокая тепло- и электро- проводность, tвл=600Со
Хим св-ва: малоактивный из-за наличия на поверх-ти оксидной плёнки
2Al+1,5 O2=Al2O3
Но при снятии оксидной плёнки Al очень активный Ме, реаг с многими вещ-вами.
Al + 1,5 Cl2=2Al+3Cl3-(хлорид Al); 2 Al+N2=2 Al+3N-(нитрид Al);Al+C=Al4+3C3-4 (карбид Al)
2Alo+6H2+O=2Al+3(OH)3+3H20↑
2Al+6HCl=2AlCl3+3H2
Al может вытеснять из оксидов менее активные Ме
Fe2O3+Al=Fe+Al2O3 (алюмотермия)
Al+H2SO4(конц) = Al2(SO4)3+H2O+S (H2S; SO2 ) реакция идёт только при нагревании
H2O+Al0+NaOH=Na[Al+3(OH)4]+H20↑
Al2O3-амфотерный оксид,
HAlO2-метаалюминевая (метаалюминат),H3AlO3- ортоалюминевая (ортоалюминат) или Al(OH)3-гидрооксид алюминия
Al(OH)3o ↔ Al(OH)2+ + OH-
Al(OH)2+ ↔ AlOH+2 + OH-
AlOH+2 ↔ Al3+ + OH-
Al2O3+3H2SO4=Al2(SO4)3+ 3H2O
Al2O3(кисл) +Na2O = 2NaAlO2 алюминат Na
Al2O3(основ) + 3SO2 = Al2(SO3)3
Al(OH)3 + 3HNO3 = Al2(NO3)3 + 3H2O сокр ион Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + 3NaOH = Na3[Al(OH)6] сокр ион Al(OH)3 + 3OH- = [Al(OH)6]
20.Строение атомов щелочных и щелоч-зем Ме, (Mg и Be). Жесткость воды.
S элементы 1 группы: H, L, K, Na, Rb, Cs, Fr; ns1 с.о. +1
S элементы 2 группы: Be, Mg, Ca, Sr, Ba, Ra; ns2 с.о. +2
Щелочные и щелоч-зем самые активные, не встречаются в свободном виде.
Li похож на Mg
Т. к. эти Ме сильные восстановители, то для их получения используют электролиз расплава.
Хим св-ва:
1. Взаимод с О2
из щелочных Ме, только Li образ оксид, Na-пероксид(Na2O2), K-надпероксид (KO2)
2Li +0,5 O2 = Li2O; 2Na+O2=Na2O2; K+O2=KO2
2KO2 + 2H2O = 2KOH + H2O + O2
2KOH + CO2 = K2CO3 + H2O
KO2 – применяется как источник О2 и поглотитель СО2
1кг КО2 поглащ 300г СО2 и выдел 380г О2
2. Взаимод с Н2
2Li + H2 = 2Lih (гидрид Li)
3. С галогенами (7А)
2Na + Cl2 = 2NaCl
с халькогенами (6А)
2Na+ S =Na2S; 6Li + N2= 2Li3+N-3 (нитрид Li)
4. С водой
2Na0+2H2+O= 2Na+OH + H20↑
Жесткость воды – содержание в воде солей кальция(Ca+2) и магния (Mg+2)
Жесткость: временная (карбонатная: Ca(HCO3)2, Mg(HCO3)2 )
постоянная (другие соли кроме: Ca(HCO3)2, Mg(HCO3)2 )
Общая жесткость: временная + постоянная
Ж= 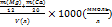
|
|
|
Хар-ка воды по жесткости:
1) очень мягкая (меньше 1.5)
2) мягкая (от1.5 до 4)
3)средняя (4 -8)
4) жесткая (8-12)
5) очень жесткая (больше 12)
Жесткая вода образует нерастворим соед с моющ вещ-ми.
Способы устранения жесткости
временная жесткость – кипячение
Ca(HCO3)2 → CaCO3↓ +CO2+H2O; Mg(HCO3)2 → CaCO3↓ +CO2 +H2O
постоянную – содой Na2CO3
CaCl + Na2CO3 = CaCO3 ↓ +2NaCl
На предприятиях временную и постоянную жесткость устраняют добавлением гашёной извести и соды Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Сейчас (современ способы) основаны на применении катионитов, которые способны обмениваться катионами.
21. Медь, серебро, золото.
Простое вещество медь — это пластичный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки. [Ar] 3d10 4s1 . В соединениях медь проявляет две степени окисления: +1 и +2. С.о. +1 устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. Не изменяется на воздухе в отсутствие влаги и CO2. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):2Cu+H2O+CO2+O2=Cu2CO3(OH)2↓
Реагирует с концентрированной холодной серной кислотой: Cu+H2SO4=CuO+SO2↑+H2O
С концентрированной горячей серной кислотой: 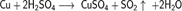 Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:


Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
|
|
|
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет: 
Комплексные соединения: Для ионов меди (II) Сu2+ характерно образование комплексных соединений, например K2[Cu(CN)4]-тетрацианокупрат (II) калия:
CuCl2 + 4KCN = К2 [Cu(CN)4] + 2КСl
Из других комплексных соединений меди (II) отметим соединение с аммиаком. Если к раствору хлорида меди (II) прилить небольшое количество раствора аммиака, то выпадет осадок гидроксида меди (II):
CuCl2 + 2NH3 + 2Н20 = Сu(ОН)2 + 2NH4Cl
Если добавить избыток аммиака, то гидроксид растворится с образованием комплексного соединения темно-синей окраски, характерной для аммиачного комплекса меди:
Си(ОН)2+ 4NH3 = [Cu(NH3)4] (ОН)2
Простое вещество серебро — ковкий, пластичный металл серебристо-белого цвета. [Kr] 4d10 5s1 Серебро отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Серебро, в отличие от золота, не растворяется в царской водке из-за образования пленки хлорида на его поверхности. Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2]+. Серебро образует комплексы так же с цианидами. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Простое вещество золото — металл жёлтого цвета. [Xe] 4f14 5d10 6s1. Золото — один из самых инертных металлов, стоящий в ряду напряжений правее всех других металлов. При нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, поэтому его относят к благородным металлам, в отличие от обычных металлов, разрушающихся под действием кислот и щелочей. Растворяется в царской водке.
Наиболее устойчивая степень окисления золота в соединениях +3, в этой степени окисления оно легко образует с однозарядными анионами (F−, Cl−. CN−) устойчивые комплексы [AuX4]−. Относительно устойчивы также соединения со степенью окисления +1, дающие линейные комплексы [AuX2]−. Соединения золота(V) стабильны лишь со фтором и являются сильнейшими окислителями.
Из чистых кислот золото растворяется только в концентрированной селеновой кислоте при 200 °C:  Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты: 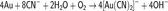
|
|
|
Цианоаураты легко восстанавливаются до чистого золота: 
22. Подгру́ппа ци́нка — химические элементы 2-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы II группы)[1]. В группу входят цинк Zn, кадмий Cd и ртуть Hg. На основании электронной конфигурации атома к этой же группе относится и искусственно синтезированный элемент коперниций Cn, эксперименты с отдельными атомами которого начали проводиться совсем недавно. Все элементы этой группы являются металлами. Близость металлических радиусов кадмия и ртути обусловлено косвенным влиянием лантаноидного сжатия. Таким образом, тренд в этой группе отличается от тренда в группе 2 (щёлочноземельные металлы), в которой металлический радиус плавно увеличивается от верхней к нижней части группы. Все три металла имеют сравнительно низкие температуры плавления и кипения, что говорит о том, что металлическая связь относительно слабая, с относительно небольшим перекрытием между валентной зоной и зоной проводимости. Таким образом, цинк близок к границе между металлами и металлоидами, которая обычно помещается междугаллием и германием, хотя галлий присутствует в полупроводниках, таких как арсенид галлия. Цинк является наиболее электроположительным элементом в группе, следовательно, он является хорошим восстановителем. Окислительно-восстановительный статус группы равен +2, причём ионы имеют достаточно стабильную d10 электронную конфигурацию, с заполненными подуровнями. Однако, ртуть легко переходит к статусу +1. Обычно, как, например, в ионах Hg22+, два иона ртути (I) соединяются в виде металл-металл и образуют диамагнитный образец. Кадмий может также формировать связи, такие как [Cd2Cl6]4−, в которых окислительно-восстановительный статус металла равен +1. Так же как и для ртути, в результате формируется связь металл-металл в виде диамагнитного соединения, в котором нет непарных электронов, делающих соединение сильно химически активным. Цинк (I) известен только в виде газа, в таких соединениях как вытянутые в линию Zn2Cl2, аналогичные каломели.
|
|
|
23. Для элементов побочных подгрупп закономерность обратная. Например, в VI группе степень окисления (+6) наименее устойчива для хрома, в VII группе – для марганца. Вследствие этого соединения хрома (+6) и марганца (+7) – сильнейшие окислители (также сильно зависят от pH). Соединения хрома (II) - сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.2CrCl2 + 2HCl ® 2CrCl3 + H2 4Cr(OH)2 + O2 + 2H2O ® 4Cr(OH)3 Соединения трёхвалентного хрома Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:2Cr(OH)3 –t°® Cr2O3 + 3H2O 4K2Cr2O7 –t°® 2Cr2O3 + 4K2CrO4 + 3O2 (NH4)2Cr2O7 –t°® Cr2O3 + N2+ 4H2O В зависимости от температур меняется и химическая активность хрома.Так при небольших температурах хром мало активен и взаимодействует только со фтором.С увеличением температуры от 6000C, начинает взаимодействовать с галогенами, серой, азотом, кремнием, бором, углеродом, кислородом.Реакция с кислородом протекает сначала довольно активно, но через некоторое время резко замедляется, так как поверхность покрывается тонкой чрезвычайно устойчивой пленкой,препятствующему дальнейшему окислению.Это явление получило название – пассивирование.Cr2O7 Cr2O3
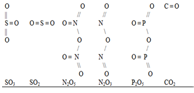 24. Подгру́ппа ма́рганца — химические элементы 7-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы VII группы)[1]. В группу входят переходные металлы марганец Mn, технеций Tc и рений Re.[2] На основании электронной конфигурации атома к этой же группе относится и элемент борий Bh, искусственно синтезированный в 1976 г. группой Юрия Оганесяна из Объединённого института ядерных исследований в Дубне. Элементы группы 7 имеют по 7 валентных электронов. Все они являются серебристо-белыми тугоплавкими металлами. В ряду Mn — Tc — Re химическая активность понижается. Электропроводность рения приблизительно в 4 раза меньше, чем вольфрама. Металл этот представляет собой прекрасный материал для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые. На воздухе компактный металлический марганец покрывается тончайшей пленкой окисла, которая предохраняет его от дальнейшего окисления даже при нагревании. Напротив, в мелко раздробленном состоянии он окисляется довольно легко. Степени окисления 7, 6, 5, 4, 3, 2, 0, +1
24. Подгру́ппа ма́рганца — химические элементы 7-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы VII группы)[1]. В группу входят переходные металлы марганец Mn, технеций Tc и рений Re.[2] На основании электронной конфигурации атома к этой же группе относится и элемент борий Bh, искусственно синтезированный в 1976 г. группой Юрия Оганесяна из Объединённого института ядерных исследований в Дубне. Элементы группы 7 имеют по 7 валентных электронов. Все они являются серебристо-белыми тугоплавкими металлами. В ряду Mn — Tc — Re химическая активность понижается. Электропроводность рения приблизительно в 4 раза меньше, чем вольфрама. Металл этот представляет собой прекрасный материал для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые. На воздухе компактный металлический марганец покрывается тончайшей пленкой окисла, которая предохраняет его от дальнейшего окисления даже при нагревании. Напротив, в мелко раздробленном состоянии он окисляется довольно легко. Степени окисления 7, 6, 5, 4, 3, 2, 0, +1
Марганцу в степенях окисления (+2), (+4), (+6) и (+7) соответствуют оксиды MnO, MnO2, MnO3 и Mn2O7. В соответствии с закономерностью, отмеченной выше, MnO – основной оксид, MnO2 − амфотерный, MnO3 и Mn2O7 – кислотные оксида. В таком случае подобно свинцу следует ожидать образование «смешанных оксидов». Действительно, в литературе приведены, например, Mn2O3, Mn3O4.В холодных концентрированных азотной и серной кислотах металлический марганец, технеций и рений пассивируются. Реакция с этими кислотами протекает при нагревании.Со щелочами металлы подгруппы марганца не взаимодействуют, но в щелочных расплавах в присутствии окислителей реакция может протекать.
14. 1)N(1s 22s 22p 3)
P(1s 22s 22p 63s 23p3)
As(1s 22s 22p 63s 23p64s 23d104p3) Sb(1s 22s 22p 63s 23p64s 23d104p65s224d105p3)
Bi(1s 22s 22p 63s 23p64s 23d104p65s2
4d105p66s24f145d106p3)
2)устойчивая для N(+5)
устойчивая для P(+1)
устойчивая для Bi(+3)
устойчивая для As(+5)
устойчивая для Sb(+5)
3)
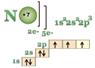
возможные степени окисления:
(0)N2; (+1)N20; (+2)NO; (+3)N203
(+4)NO2; (+5)N2O5; (-3)NH3
4) Аммиак можно получить нагреванием смеси соли ‑ хлорида аммония и гидрооксида кальция. При нагревании смеси происходит реакция образования соли, аммиака и воды.
2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 + 2H2O
вост. св-ва аммияка:
4NH3 + 3O2 → 2N2 + 6H20
4NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
5)NH4Cl = NH3 + HCl
(NH4)2+CO3 =2NH3 +CO2+ H2O
15. 1) N2O (N-O-N); NO(N=O); N2O3(); NO2(O=N=O); N2O5
2)кислоты: HNO3; HNO2
соли: NH4NO2; NaNO3
3)металл+HN03=нитрат+вода+газ
3Li + 4HNO3(разб.) = 3LiNO3 + NO↑ + 2H2O
Mg+HNO3= Mg(NO3)2+H2↑
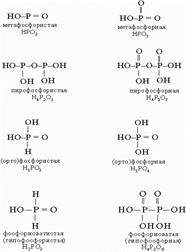
16. 1) Р2О3; Р2О5 PО3;P4O
2) кислоты: HPO2; HPO3; H4P2O5; H4P2O7; H3PO4; H3PO3; H3PO2; H4P2O6
соли: Ca3(PO3)2; Na3PO4
 3) Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и черному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов. В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
3) Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и черному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов. В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействует со многими простыми веществами – галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:с металлами – окислитель, образует фосфиды:2P + 3Ca = Ca3P2.с неметаллами – восстановитель:2P + 3S = P2S3,2P + 3Cl2 = 2PCl3.Не взаимодействует с водородом.
Взаимодействие с водой Взаимодействует с водой, при этом диспропорционирует:4Р + 6Н2О = РН3 + 3Н3РО2 (фосфорноватистая кислота).
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 648; Нарушение авторских прав?; Мы поможем в написании вашей работы!