
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отклонения от закона Рауля
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных — отрицательные отклонения.
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0); объём раствора в этом случае будет меньше, чем сумма исходных объёмов компонентов (ΔV < 0).
Растворы электролитов. Неподчинение растворов электролитов законам Вант-Гоффа и Рауля.
Электролиты - это вещества, растворы и расплавы которых проводят электрический ток (кислоты, соли, щёлочи). Эти растворы сильно отклоняются от всех рассмотренных законов. Для них осмотическое давление, понижение давления пара, изменения температур кипения и замерзания всегда больше, чем это отвечает концентрации раствора. Например, понижение температуры замерзания раствора, содержащего 1г NaCl в 100 г воды, почти вдвое превышает изменение температуры замерзания, вычисленное по законам Рауля. Во столько же раз и осмотическое давление этого раствора больше теоретической величины. Чтобы распространить уравнение осмотического давления на растворы электролитов, Вант-Гофф ввёл в него поправочный коэффициент i (изотонический коэффициент), показывающий, во сколько раз осмотическое давление данного раствора больше "нормального":. Коэффициент i определяется для каждого раствора экспериментальным путём - например по понижению давления пара, или по понижению температуры замерзания, или по повышению температуры кипения: Способность электролитов в растворах проводить электрический ток и их отклонения от законов Рауля и Вант-Гоффа объясняет теория электролитической диссоциации Аррениуса.
Билет №31
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
 См за место последнего множителя
См за место последнего множителя
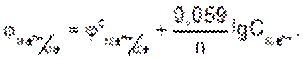
Билет №32
ЭДС как разность потенциалов электродов ΔE = Eкатода - Eанода.
 А…. ….К
А…. ….К
В ряду напряжения
Алессандро Вольта опытным путём установил ряд напряжений металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. Сила гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга члены ряда.
Стандартные электродные потенциалы увеличиваются в ряду: Li < K < Rb < Cs < Ba < Ca < Na < Mg < Al < Mn < Cr < Zn < Fe < Cd < Co < Ni < Sn < Pb < H2 < Cu < Ag < Hg < Pt < Au.
Билет №33
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисления металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:

При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента.
Механизм электрохимической коррозии может протекать по двум вариантам:
1) Гомогенный механизм электрохимической коррозии:
- поверхностный слой мет. рассматривается как гомогенный и однородный;
- причиной растворения металла является термодинамическая возможность протекания катодного или же анодного актов;
- К и А участки мигрируют по поверхности во времени;
- скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
- однородную поверхность можно рассматривать как предельный случай, который может быть реализован и в жидких металлах.
2) Гетерогенный механизм электрохимической коррозии:
- у твердых металлов поверхность негомогенная, т.к. разные атомы занимают в сплаве различные положения в кристаллической решетке;
- гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного мет. происходит именно на анодах.
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому его разрушению.
При работе гальванического элемента одновременно протекает два электродных процесса:
Анодный - ионы металла переходят в раствор
Происходит реакция окисления.
Катодный - избыточные электроны ассимилируются молекулами или атомами электролита, которые при этом восстанавливаются. На катоде проходит реакция восстановления.
Коррозия металлапроисходит именно на аноде.
Для эксплуатации металлоизделий в агрессивных средах, необходима более стойкая антикоррозионная защита поверхности металлоизделий. Термодиффузионное цинковое покрытие является анодным по отношению к чёрным металлам и электрохимически защищает сталь от коррозии.
Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии * разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент *:
А (–) Cr | H2O, O2 | Fe (+) К
на аноде: Cr – 2e → Cr2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Cr2+ + 2 OH– → Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
4 Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия. У катодного покрытия стандартный электродный потенциал * более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
А (–) Fe | H2O, O2 | Sn (+) К
на аноде: Fe – 2e → Fe2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Fe2+ + 2 OH– → Fe(OH)2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
Билет №34
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Примеры электролиза расплавов:
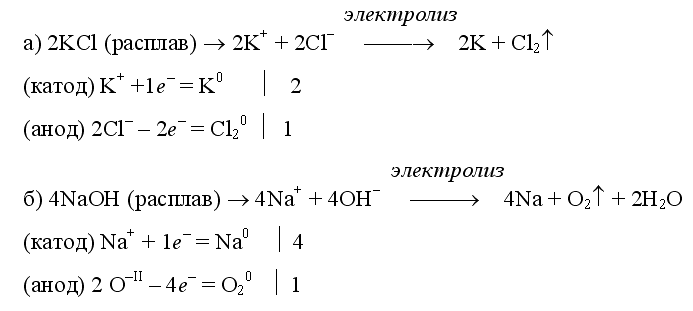
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):
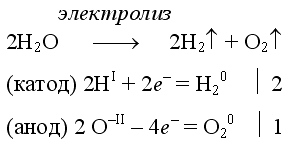
Билет №35
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество. Законы Фарадея можно записать в виде следующей формулы:
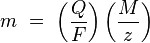
где:
· m — масса осаждённого на электроде вещества в граммах
· Q — полный электрический заряд, прошедший через вещество
· F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея
· M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль)
· z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества.

и тогда
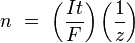
где:
n — выделенное количество вещества («количество молей»): n = m/M
t — время действия постоянного тока.
Билет №36
Диспе́рсная систе́ма — это образования из двух или большего числа фаз (тел), которые практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
Классификация дисперсных систем
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
| Обозначение | Дисперсная фаза | Дисперсионная среда | Название и пример |
| Г/Г | Газообразная | Газообразная | Не образуют дисперсные системы |
| Ж/Г | Жидкая | Газообразная | Аэрозоли: туманы, облака |
| Т/Г | Твёрдая | Газообразная | Аэрозоли (пыли, дымы), порошки |
| Г/Ж | Газообразная | Жидкая | Газовые эмульсии и пены |
| Ж/Ж | Жидкая | Жидкая | Эмульсии: нефть, крем,молоко |
| Т/Ж | Твёрдая | Жидкая | Суспензии и золи: пульпа, ил, взвесь, паста |
| Г/Т | Газообразная | Твёрдая | Пористые тела: поролон,пемза |
| Ж/Т | Жидкая | Твёрдая | Капиллярные системы: жидкость в пористых телах, грунт, почва |
| Т/Т | Твёрдая | Твёрдая | Твёрдые гетерогенные системы: сплавы, бетон,ситаллы, композиционные материалы |
По кинетическим свойствам дисперсной фазы дисперсные системы можно разделить на два класса:
· Свободнодисперсные системы, у которых дисперсная фаза подвижна;
· Связнодисперсные системы, дисперсионная среда которых твердая, а частицы их дисперсной фазы связаны между собой и не могут свободно перемещаться.
В свою очередь эти системы классифицируются по степени дисперсности.
Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами — полидисперсными. Как правило, окружающие нас реальные системы полидисперсны.
По размерам частиц свободнодисперсные системы подразделяют на:
| Название | Размер частиц, м |
| Ультрамикрогетерогенные | 10−9…10−7 |
| Микрогетерогенные | 10−7…10−5 |
| Грубодисперсные | более 10−5 |
Билет №37
Методы диспергирования
– механическое диспергирование – осуществляется под действием внешней механической работы. Способы: истирание, раздавливание, раскалывание, распыление, барботаж (пропускание струи воздуха через жидкость), встряхивание, взрыв, действие звуковых и ультразвуковых волн. Таким методом получают муку, сахарную пудру, какао порошок, пряности.
электрическое диспергирование – основан на образовании вольтовой дуги между электродами из распыляемого металла, помещенными в охлаждаемую ДС. Металлы при температуре вольтовой дуги испаряются, а затем в холодной ДС конденсируются. Таким методом получают в основном гидрозоли металлов (дисперсионной средой является вода), например серебра, золота и платины.
– диспергирование ультразвуком – основано на воздействии при помощи ультразвуковых колебаний с частотой выше 20 тыс. в 1 с., не улавливаемых человеческим ухом, эффективно лишь для веществ с небольшой прочностью. К ним относят серу, графит, крахмал, каучук, желатин и др.
К физико-химическому диспергированию относится метод пептизации. Он заключается в переводе свежеприготовленных рыхлых осадков в коллоидный раствор под действием специальных стабилизирующих добавок (пептизаторов – электролиты, растворы ПАВ). Действие пептизатора заключается в том, что частицы осадка отделяются друг от друга и переходят во взвешенное состояние, образуя золь. Таким методом можно получить, например, гидрозоль гидроксида железа (III). Метод пептизации можно применять только для свежеприготовленных осадков, так как в процессе хранения происходят процессы рекристаллизации и старения, приводящие к сращиванию частиц друг с другом. Размеры частиц получаемых данным методом около 1 нм.
Билет №38
Оптическое свойство коллоидных систем – опалесценция, т.е. рассеивание света малыми частицами, приводящее, в частности, к возникновению эффекта Фарадея-Тиндаля – луч света в дисперсной системе становится видимым.
Молекулярно-кинетические свойства – диффузия, броуновское движение, седиментация связанны с хаотическим тепловым движением частиц.
Броуновское движение – беспорядочное движение частиц. А.Эйнштейн и независимо от него М. Смолуховский развили молекулярно-статистическую теорию броуновского движения, доказав, что оно является отражением теплового, хаотичного движения молекул дисперсионной среды. Интенсивность движения возрастает с повышением температуры, уменьшением размеров частиц и вязкости среды.
Диффузия – самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации. Скорость диффузии при постоянных температуре и вязкости среды зависит от величины и формы частиц. Особые формы диффузии – осмос и диализ. Осмос – диффузия частиц растворителя через полупроницаемую мембрану. Диализ – диффузия частиц растворенного вещества через полупроницаемую мембрану.
Седиментация – свободное оседание частиц в вязкой среде под действием гравитационного поля. Седиментируют только достаточно крупные частицы. Закон Стокса: скорость оседания прямо пропорциональна ускорению гравитационного поля Земли, разности плотностей частиц и окружающей среды, квадрату радиуса оседающих сферических частиц и обратно пропорциональна вязкости среды.
Билет №39
|
|
Дата добавления: 2015-08-31; Просмотров: 1299; Нарушение авторских прав?; Мы поможем в написании вашей работы!