
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И строение молекул
|
|
|
|
ТЕМА 2. Учение о химической связи
Основные вопросы
Квантово-механические представления о возможности возникновения химической связи между атомами. Характеристики химической связи: длина связи, энергия связи, валентный угол.
Основные положения метода валентных связей (ВС). Ковалентная связь. Насыщаемость ковалентной связи. Валентность. Гибридизация атомных орбиталей при образовании связи, s, p; -связи. Полярные и неполярные молекулы.
Ионная связь как крайний случай полярной ковалентной связи. Водородная и металлическая связи.
Кристаллическое и аморфное состояние вещества. Кристаллические решетки и их типы. Зависимость свойств соединений от типа кристаллической решетки.
Методические указания
Прежде всего, усвойте основные химические понятия, необходимые для изучения данной темы.
Молекулой называют наименьшую нейтральную частицу данного вещества, обладающую его химическими свойствами и способную к самостоятельному существованию.
Различают одно-, двух-, трех- и многоатомные молекулы.
Ион - заряженная частица - это атом или группа атомов с избытком (-) или недостатком (+) электронов.
В веществе положительные ионы существуют вместе с отрицательными.
Свободный радикал - частица, обладающая ненасыщенными валентностями.
Например, . CH3, . NH2. Они при обычных условиях не существуют длительное время, т.к. весьма реакционноспособны.
При взаимодействии атомов между ними возникает химическая связь. Она приводит к образованию устойчивой системы - молекул, ионов и т.д. Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы. Чем прочнее химическая связь, тем больше энергии нужно затратить для ее разрыва. Мерой прочности химической связи служит энергия разрыва связи. Она всегда положительна, иначе связь самопроизвольно разорвалась бы с выделением энергии. Следовательно, при образовании химической связи выделяется энергия за счет уменьшения потенциальной энергии системы взаимодействующих электронов и ядер. Таким образом, условием образования химической связи является уменьшение потенциальной энергии взаимодействующих атомов.
|
|
|
Изучение темы начинают с первых моделей химической связи Косселя и Льюиса и на их основе продолжают рассматривать основные типы связи: ковалентную (полярную и неполярную) и ионную. Обратите внимание на то, что донорно-акцепторная связь - лишь разновидность ковалентной связи, т.е. другой способ ее образования (пара электронов предоставляется одним атомом). Современные представления о природе химической связи удобно разобрать на примере образования молекулы водорода.
Важно усвоить, что природа всех видов химической связи едина - это электрические взаимодействия, возникающие при сближении ядер атомов. В общем виде причиной образования молекул из свободных атомов является понижение энергии молекулы по сравнению с суммой отдельных атомов. На основе современных представлений о строении атома объясните свойства химической связи: энергию, длину, насыщаемость, направленность, полярность. Разберитесь, как тип химической связи отражается на строении молекул, почему существуют молекулы с линейным строением, плоскостным, тетраэдрическим.
С этой целью необходимо ознакомиться с методом гибридизации атомных орбиталей, который исходит из предположения, что при образовании молекул вместо исходных s-, p- и d-электронных облаков образуются равноценные “гибридные” электронные облака, вытянутые по направлению к соседним атомам. Это способствует более полному перекрыванию с электронными облаками этих атомов, что приводит к образованию более прочной химической связи и, следовательно, есть выигрыш энергии, который идет на компенсацию затрат энергии при гибридизации.
|
|
|
При гибридизации, таким образом, уменьшается потенциальная энергия образующейся молекулы, что приводит к повышению ее устойчивости.
 Пример. BeF2
Пример. BeF2
атом F ¯ ¯ 1s2 2s2 2p5
¯ два спаренных электрона, один - неспаренный

атом Ве 1s2 2s2
¯ нет неспаренных электронов
Для участия в химической связи атом бериллия должен перейти в возбужденное состояние
 |
1s2 2s12p1
два неспаренных электрона 2s1 и 2p1
При перекрывании этих двух электронных облаков с электронными облаками атома фтора образуется ковалентная связь.
 Be
Be
+ + 2s
· · ·
+
F Be
Be
_
· + + · _ ·
+
F Be
Образуются в результате затраты некоторой энергии две sp-гибридные орбитали. Эти sp-орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы.
 |
 · · ·
· · ·
F Be F
Возможны и другие случаи гибридизации атомных орбиталей.
Число гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации.
sp2-гибридизация: три орбитали 1s и 2р
BF3 B(CH3)3 -триметилбор; B(OH)3 - борная кислота; NO3-

 2s 2р
2s 2р
B ¯ В возбужденном состоянии: В*
При гибридизации с орбиталями F образуются три гибридных:
 |
форма треугольника
120О в центре - атом В
в вершинах - F
все три связи равноценны
Гибридизация: sp3 Si, Ge, NH4+, PO43-
1s2 2s2 2p4 SiH4, SnC14, CC14
H2O
O 2s 2p
 ¯ ¯
¯ ¯
 O* 2s 2p 3s
O* 2s 2p 3s
¯
3-p 1-s
sp3 - 4 орбитали гибридных

104О28’
тетраэдр
109О5’ отличается угол (104О3’), т.к. у О2 есть две пары электронов 2s2 и 1s2 это приводит к ассоциации.
sp3
CH4 1s2 2s2 2p2
 2s2 2p2 2s 2p
2s2 2p2 2s 2p
¯ ® 4 орбитали
1 3
 |
109О5’ тетраэдр
NH3 - sp3 не тетраэдр

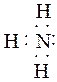 |
N ¯
 ® 1s2 2s22p3
® 1s2 2s22p3
октаэдрическая конфигурация d2sp3 две d’ орбитали
Шесть гибридных орбиталей, каждая из которых ориентирована к центру грани куба. Три взаимоперпендикулярные р-орбитали, две d-орбитали и s- сферическая гибридизируются. Причем энергии орбиталей должны быть примерно равны
|
|
|
 3 d, 4 s и 4p на единицу меньше главного квантового числа.
3 d, 4 s и 4p на единицу меньше главного квантового числа.
Типы симметрий
| Гибрид | Симметрия | Пример |
| sp | линейная | HgC12 |
| sp2 | тригональная | BC13 |
| sp3 | тетраэдрическая | CC14 |
| dsp2 | плоская квадратная | AuC14-, Ni(CN)42-, PdC142-, Pt(NH3)2C12 |
| dsp3 | тригонально-бипирамидальная | PC15 |
| d2sp3 | октаэдрическая | PtC162- |
| d4sp3 | додекаэдрическая | Mo(CN8)4- |
Рассматривая металлическую связь, следует иметь в виду, что это понятие отражает специфику объекта-металла, а действующие между атомами (ионами) силы имеют также электрическую природу. Особенностью водородной связи (при межмолекулярном виде взаимодействия) является то, что в отличие от перечисленных видов связи, возникающих между атомами, она осуществляется между молекулами.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!