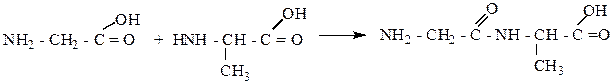КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ТЕМА 11. Основные законы термодинамики. Термохимия
|
|
|
|
Методика решения типовых задач
Задача: Что такое пептиды и пептидная связь? Напишите схему образования дипептида из глицина и аланина.
Решение. Различные аминокислоты, образуя белки, соединяются за счет карбоксильных и аминогрупп при помощи группировки -СО-NH-, называемой пептидной связью. Продукт взаимодействия двух аминокислот называется дипептидом, многих - полипептидом. Образование полипептидов из a-аминокислот лежит в основе синтеза белковых веществ в живых организмах. Схему реакции образования дипептида можно представить следующим образом:
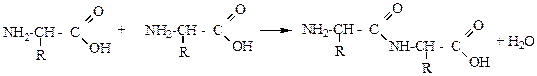
где R - различные группы атомов.
Запишем схему синтеза дипептида глицилаланин:
|
Дополнительно стоит отметить возможность образования побочных продуктов реакции, таких дипептидов как аланилглицин, аланилаланин, глицилглицин.
Основные вопросы
Основные понятия (система, фаза, термодинамические параметры, функции состояния, самопроизвольные и несамопроизвольные процессы).
Первый закон термодинамики, его различные формулировки, математическое выражение закона. Применение к изотермическому, изохорному и изобарному процессам. Мировоззренческое значение закона.
Термохимия. Тепловые эффекты экзотермических и эндотермических реакций. Закон Гесса и его следствия. Расчет тепловых эффектов реакции по стандартным теплотам образования и сгорания исходных веществ и продуктов реакции..
Второй закон термодинамики, его различные формулировки. Математическое выражение закона. Энтропия и термодинамическая вероятность системы, уравнение Больцмана. Энтропия как мера неупорядоченности в системе.
Термодинамические потенциалы системы. Энергия Гельмгольца (изохорно-изотермический потенциал) и энергия Гиббса (изобар-но-изотермический потенциал). Изменение потенциалов как характеристика работоспособности системы. Критерии направления процессов в изолированных системах – изменение энтропии, и в неизолированных (закрытых) системах – изменение потенциалов Гельмгольца и Гиббса.
|
|
|
Методические указания
Вспомните из курса физики, что электрическая, механическая, тепловая и химическая энергии при различных процессах могут превращаться в другие виды энергии (друг в друга). Возможность и направления перехода энергий и количественное соотношение между различными видами энергий изучает термодинамика.
Химическая термодинамика рассматривает превращение различных видов энергии при химических процессах. Законы химической термодинамики позволяют предсказать возможность протекания реакций при данных условиях, каков будет выход продуктов и каков будет тепловой эффект реакции. Реакции, протекающие с выделением тепла могут служить источниками тепловой энергии. Энергетические эффекты дают информацию о строении соединений, межмолекулярных связях и реакционной способности.
Запомните основные понятия, используемые в термодинамике: система, фаза, термодинамический процесс, параметр, цикл. Разберите, в чём состоит отличие между гомогенной и гетерогенной системами, а также – открытой, неизолированной и закрытой системами.
Затем познакомьтесь с основными термодинамическими функциями состояния системы, а именно:
Внутренняя энергия(U) - запас энергии системы независимо от того, в каком состоянии она находится. Внутренняя энергия - общий запас энергии системы, которая складывается из энергии движения молекул, ядер и электронов в молекулах и атомах, межмолекулярного взаимодействия. Из общего запаса энергии следует вычесть кинетическую энергию системы и потенциальную энергию ее положения. Для изолированной системы сумма всех видов энергии постоянная U=const. Обычно говорят об изменении внутренней энергии:
|
|
|
D U = U2 - U1
Поскольку абсолютную величину внутренней энергии определить невозможно DU>0 если в процессе внутренняя энергия возрастает и наоборот.
Изменение внутренней энергии при переходе ее от одного тела к другому подразделяют на:
· переход энергии за счет хаотического столкновения молекул соприкасающихся тел. Мера энергии в этом случае - теплота (Q);
· переход энергии при перемещении масс - поднятие тел в поле тяготения, переход электричества от большего к меньшему потенциалу, расширение газа и т.п. Мера в этом случае - работа (А).
Внутренняя энергия во многих случаях может передаваться частично в виде теплоты и частично в виде работы.
Теплота и работа количественно и качественно характеризуют две различные формы передачи энергии. U, Q и А измеряются в одних величинах кДж/моль или кДж.
Энтальпия (Н) - мера энергии, накапливаемая веществом при его образовании:
Н = U + pV
где р - давление в системе, V – объем системы.
Энтальпия – теплосодержание – функция состояния. Изменение энтальпии всецело определяется начальным и конечным состоянием системы и не зависит от пути протекания процесса.
Состояние системы - природа веществ и продуктов реакции, агрегатное состояние и температура. Агрегатное состояние должно быть устойчивым при данной температуре.
Основной принцип, на котором основываются термохимические расчеты, установлен в 1840г. русским химиком Г.И.Гессом. Далее рассмотрите закон Гесса и следствия из него.
Наконец, разберите, как изменяются функции состояния системы при различных термодинамических процессах:
1. Изохорные процессы (V=const.).
При этом не изменяется объем системы и, следовательно, работа А=0.
QV = DU
DН=DU + pDV
DНV =DU
Энергия системы расходуется на изменение ее внутренней энергии (нагревание газа в замкнутом объеме приводит к изменению его внутренней энергии).
2. Изобарные процессы (р = const). Большинство химических процессов протекают при постоянном давлении. Часто при этом происходит изменение объема:
DV = V1 - V2
А = р DV
DН=DU + pDV
DНр=DU + А
При изобарном процессе энергия системы расходуется на изменение внутренней энергии и работу расширения.
|
|
|
3. Изотермические процессы (t=const).
р = RT/V - закон состояния идеального газа.
А = рDV
А = n 2/303 RT lg(V2/V1),
где n – число молей газа.
Из закона Бойля-Мариотта:
р1/p2 = V1/V2, pV=const.
А = n 2/303 RT lg(p1/p2),
4. Адиабатические процессы - процессы в полной тепловой изоляции - реакции при взрыве - протекают за короткий промежуток; работа при этом - работа расширения - происходит за счет уменьшения внутренней энергии DА=-DU, так как теплообмена с окружающей средой нет, но изменение внутренней энергии газа пропорционально изменению его температуры. СV - коэффициент пропорциональности - удельная теплоемкость газа.
DU = CV DT
-DA = CV DT - работа адиабатического процесса.
CV - количество тепла, сообщаемое одному молю газа при повышении температуры на 1оС.
Далее перейдите к рассмотрению основных законов термодинамики.
1. Первый закон термодинамики устанавливает зависимость между внутренней энергией, работой и теплотой и утверждает, что в любой изолированной системе запас энергии остается постоянным. Отсюда закон эквивалентности различных форм энергии: разные формы энергии переходят друг в друга в строго эквивалентных количествах.
Вечный двигатель первого рода невозможен, так как невозможно построить машину, которая давала бы механическую работу, не затрагивая при этом соответствующее количество молекулярной энергии.
Внутренняя энергия изменяется при совершении системой работы, при поглощении и выделении теплоты. В термодинамике:
Теплота поглощаемая +Q = -ΔH.
Теплота выделяемая -Q = +ΔH.
Смысл первого закона термодинамики выражается уравнением: D U = Q - A., то есть увеличение внутренней энергии системы равно сообщенному системе теплу минус произведенная системой работы.
Для изолированной системы D U=const во всех превращениях. Одна форма энергии превращается в другую, но полная внутренняя энергия сохраняется. Первый закон термодинамики не указывает, в каком направлении протекает процесс, но зато выражает неуничтожимость и эквивалентность различных форм энергии при различных переходах.
|
|
|
2. Второй закон термодинамики определяет самопроизвольность протекания процесса (без затрат извне).Согласно ему в изолированной системе самопроизвольно протекают только те процессы, при которых энергия переходит от более высокого уровня к более низкому.Второй закон дает возможность определить условия, которые необходимы для протекания процесса в нужном направлении и в требуемой степени. Он определяет состояние равновесия в данных условиях, количество работы, которая может быть получена; какие процессы протекают самопроизвольно при данных давлении, температуре, объеме.
Второй закон имеет ограниченную область применения, он носит статистический характер и применим к системам из большого числа молекул. Он указывает на вероятность данного процесса. Тепло превращается в работу в тепловых машинах (см. рисунок). Они осуществляют работу за счет превращения тепла от источника (нагревателя). Но не все тепло нагревателя может быть превращено в работу. Некоторая часть тепла обязательно переходит к телу с низкой температурой (холодильнику).
Т1 Нагреватель

Q1
Тепловой двигатель
Q2
T2 Холодильник
Принципиальная схема тепловой машины.
Если принять, что Q1 - тепло, полученное от нагревателя, Q2 - тепло, отданное холодильнику, то работа производиться за счет разности теплот:
Q1 - Q2 = A
Отношение работы, производимой машиной к величине тепла, полученного от нагревателя называется термодинамическим коэффициентом полезного действия КПД.:
h = A/Q1 = (Q1 - Q2)/Q1
Математическая трактовка второго закона термодинамики: нельзя достичь 100% КПД, но чем больше разность температур холодильника и нагревателя, тем полнее используется теплота.
Работа в тепловых машинах осуществляется за счет круговых процессов (циклов) в которых рабочее тело (газ) получив тепло и совершив работу возвращается в исходное состояние. Остановитесь на рассмотрении цикла Карно. Цикл состоит из четырех процессов: изотермического расширения, адиабатического расширения, изотермического сжатия и адиабатического сжатия. Процессы проводятся обратимо.
A1 = RTln(V2/V1) = Q1
A2 = -ΔU = -CV(T1-T2)
A3 = -ΔQ2 = - RTln(V4/V3)
 р
р
р1
V1 V2 V3 V4 V
Цикл Карно для одного моля идеального газа
Кривая 1-2: ΔU =const, так как T = const.
Кривая 2-3 адиабатическое расширение (Q = const.)
Кривая 3-4 - сжатие газа при постоянной температуре Т2 - температуре холодильника
Кривая 4-1 - адиабатическое сжатие до Т1.
Когда объем газа достигает V4, отсоединяем систему от холодильника, изолируем от внешней системы и адиабатически сжимаем до V1 (4-1). Газ нагревается до Т1, т.е. полностью возвращается в исходное положение:
A4 = ΔU = C(T1 - Т2)
Таким образом, процесс является круговым. Газ (система - 1 моль газа) вернулась к первоначальному состоянию температуры, давления, объема.
ΔUконечного состояний = ΔUначального состояния
Работа процесса совершена за счет полученного тепла:
А = А1 + А2 + А3 + А4
Работа совершена газом за счет разности теплот Q1-Q2 (то есть тепла полученного от нагревателя и отданного холодильнику):
А = Q1 - Q2
Q1 = RT1 ln(V2/V1) Q2 = RT2 ln(V4/V3), но V2/V1= V4/V3
А = Q1 - Q2 = R (T1 - T2)ln V2/V1
A/Q1 = (Q1 - Q2)/Q1 = (T1 - T2)/T1
(Q1 - Q2)/Q1 = (T1 - T2)/T1 = h
Т1 - температура нагревателя, Т2 - температура холодильника.
Таким образом, не все тепло, полученной рабочим телом от нагревателя в тепловой машине, работающей по циклу Карно превращено в работу, а лишь часть его Q1 - Q2. И КПД теплового двигателя зависит только от температур нагревателя и холодильник и не может быть равно единице.
Формулировка второго закона термодинамики:
Наибольший КПД теплового двигателя не зависит от природы и вида тепла и вещества, участвующих в работе машины, а только от температур теплоотдатчика и теплоприемщика.
Все виды энергии могут целиком превращаться в теплоту. Обратный полный переход тепловой энергии в механическую работу невозможен.
КПД тепловых двигателей значительно меньше единицы. КПД электрических двигателей (в реальных условиях) равен 96%. Электрическая энергия может быть практически полностью превращена в тепловую энергию или в механическое движение, что осуществляется в нагревательных приборах.
Уясните, что такая неравноценность тепловой энергии(по отношению к другим видам энергии) связана с природой тепловой энергии.
Электрическая энергия - энергия упорядоченного движения потока электронов.
Механическая энергия - энергия упорядоченного движения тел.
Тепловая энергия - энергия хаотического движения молекул.
Само собой беспорядочное движение не может перейти в направленное, тогда как обратный переход возможен. И поэтому, тепловая энергия не может быть полностью превращена в другие виды энергии.
Мерой превращаемости тепла в работу является функция состояния, зависящая от температуры и давления. Клаузиус (1865 г) предложил назвать величину, которая отражает эту меру энтропией (от греч. Превращение) - S.
Энтропия (S) - количественная мера беспорядка. Она является непрерывной, конечной и однозначной функцией состояния системы и измеряется в ккал/моль градус. Также как внутренняя энергия, энтропия является характеристикой системы. Ее также нельзя полностью измерить. И судят только об ее изменении ΔS. Являясь мерой необратимости процесса энтропия прямопропорциональна теплоте и обратнопропорциональна температуре:
ΔS = Q/T
Изменение энтропии в процессе равно отношению теплового эффекта процесса и абсолютной температуры.
Подставив значение Q = TΔS в уравнение первого начала термодинамики Q = ΔU + ΔA, получим:
TΔS = ΔU + ΔA
или
ΔU = TΔS - ΔA
Рассматривая это уравнение можно заключить, что внутренняя энергия состоит из двух частей.
Первая часть - произведенная работа. Эта работа производится системой за счет энергии, которую называют свободной энергией или изобарно-изотермическим потенциалом. В химических процессах одновременно протекают две тенденции: стремление частиц объединиться в более сложные, что уменьшает энтропию, и стремление частиц разъединиться, что увеличивает энтропию. Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных температуре и давлении и отражается в изобарном потенциале или энергии Гиббса:
DG = DН - ТDS
вторая часть внутренней энергии связана с теплотой. Она не переходит в работу, а всегда остается в теле в виде тепла - ТDS - связанная энергия - энтропийный фактор. ТDS - показывает, какое количество теплоты бесполезно рассеяно в самом совершенном двигателе (связанная энергия).
DН = DG - ТDS
DS = (DН - DG)/Т - количество связанной энергии, отнесенной к абсолютной температуре.
Поскольку энтропия является мерой беспорядка, то она уменьшается с понижением температуры.
3. Третий закон термодинамики гласит: энтропия любого тела при температуре абсолютного нуля равна нулю. Энтропия зависит от теплоемкости тела.
ΔS = Q/T, ΔS = СрΔТ/T,
где Ср - изобарная теплоемкость.
Энтропия изменяется и при фазовых переходах. Стандартная энтропия DS2980 (температура 25оС и давление 760 мм.рт.ст).
Второе начало термодинамики устанавливает, что в изолированных системах могут самопроизвольно протекать только процессы, сопровождающиеся возрастанием энтропии. Для решения вопроса о возможности протекания реакции необходим количественный критерий принципиальной осуществимости процесса. С помощью такого критерия можно определить насколько далеко идет процесс, как влияют на течение процесса температура и давление, можно ли заставить реакцию протекать в обратном направлении.
Движущая сила процесса - изобарный потенциал (ΔG). Убыль этого потенциала не зависит от пути процесса и он равен максимальной работе при переходе к равновесному состоянию:
-ΔG = А'max
самопроизвольное протекание реакции (без затраты работы) возможно только в направлении, приближающем систему к состоянию равновесия. Критерием протекания процесса является убыль G, то есть ΔG < 0. Чем меньше нуля ΔG, тем дальше система от состояния равновесия, тем более она реакционноспособна.
DG < 0 - самопроизвольное протекание процесса.
DG > 0 - индикатор принципиальной невозможности протекания процесса в обратном направлении (при данных давлениях, температуре протекать процесс не может).
Состояние равновесия характеризуется:
DG = 0
DG = DН - ТDS
Запомните, что протеканию процессов способствует сочетание условий: DН<0, DS>0. Энтальпия обычно мало зависит от температуры, ТDS растет с повышением температуры. Влияние энтропии можно ориентировочно оценить по изменению объема в система.
Стандартный изобарно-изотермический потенциал образования - изменение изобарного потенциала при протекании реакции образования одного моля соединения из простых веществ при стандартных условиях.
DG2980обр для простых веществ равна нулю. Изменение DG2980обр не зависит от пути процесса:
DG = S (DGобр.)кон. - S (DGобр.)исх.
В состоянии равновесия в реагирующей системе концентрации веществ (парциальное давление) не изменяются:
 |
AA + bB + … = dD + eE + …
Глубина протекания процесса определяется константой равновесия. Чем больше константа равновесия, тем полнее происходит взаимодействие веществ и тем больше убыль свободной энергии.
DGТо = RT lnK
По значению DGТо можно определить константу равновесия и С(р) равновесие. Это соотношение является универсальным (применимым к любому равновесию).
Если значение энергии Гиббса существенно меньше нуля, то реакции практически идут до конца, если существенно больше нуля - то реакция практически не идет. При значении энергии Гиббса равном нулю и К=1 прямая и обратная реакции идут одинаково.
Исходя из первого и второго начала термодинамики, формулы КПД, цикла Карно при температуре, равной абсолютному нулю можно сделать вывод, что все затраченное тепло может быть превращено в работу, вся внутренняя энергия является свободной энергией (КПД=1) и Аmax равно тепловому эффекту:
Аmax = Q + qV
где qV - теплота фазового перехода.
h = (Т1 - Q)/Т1 = 1 и U = Q+F = F
Аmax = qV
В 1907 г. Нернст высказал предположение, что эти соотношения справедливы и в области температур, близких к абсолютному нулю. В области весьма низких температур вся тепловая энергия может быть превращена в любой другой вид энергии и тепловой эффект реакции равен ее максимальной работе. Теорема позволяет вычислить Аmax пользуясь только значениями теплового эффекта при одной температуре (Q) и теплоемкостей веществ в широком интервале температур.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1479; Нарушение авторских прав?; Мы поможем в написании вашей работы!