КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дисперсные системы. ТЕМЫ 13-14. Теоретические основы коллоидной химии
|
|
|
|
ТЕМЫ 13-14. Теоретические основы коллоидной химии.
Методика решения типовых задач
Задача: Как изменится скорость реакции 2NO + O2 = 2NO2, если увеличить давление в два раза?
Решение. Для системы газообразных веществ изменение давления равносильно изменению концентрации, так как давление газа и его объем находятся в обратно пропорциональной зависимости. При постоянной массе вещества увеличение давления (ведущее к уменьшению объема) отвечает увеличению концентрации.
Скорость реакции до изменения давления:
W1 = k ·С2NO ·CO
а после изменения давления:
W2 = k(2 CNO)2 ·(2CO ) = 8kC2NO · CO
W2 / W1 = 8,
т.е. скорость реакции возрастет в 8 раз.
Задача: Чему равен температурный коэффициент скорости реакции, если при увеличении температуры от 10 до 40ОС скорость реакции возросла в 27 раз?
Решение. По правилу Вант-Гоффа следует:
Wt2 = Wt1 · g 10
где:
Wt1 – скорость реакции при начальной температуре t1(10ОС);
Wt2 – cкорость реакции при конечной температуре t2 (40ОC);
g10 - температурный коэффициент скорости реакции, показывающий, во сколько раз возрастает скорость реакции при повышении температуры на 10ОС.
По условию задачи Wt2 = 27 Wt1. Подставив вместо Wt2 его значение (27 Wt1) и сократив обе части уравнения на Wt1, получим:
27Wt1 = Wt1· g (40-10)/10
или 27 = g3.
Отсюда g = Ö 27 = 3.
Задача: Как повлияет понижение температуры на состояние равновесия экзотермической реакции: 2CO+О2 «2CO2?
Решение. Реакция экзотермическая (идет с выделением тепла). По принципу Ле-Шателье понижение температуры, т.е. отвод тепла, будет способствовать прямой реакции (равновесие сместится в сторону протекания прямой реакции).
Основные вопросы
Гетерогенные дисперсные системы, их значение в производстве продовольственных и непродовольственных товаров. Основные понятия дисперсных систем: дисперсная фаза, дисперсионная среда, степень дисперсности и удельная поверхность. Классификация гетерогенных дисперсных систем по размеру частиц, агрегатному состоянию фазы и среды, взаимодействию между фазой и жидкой дисперсионной средой, по взаимодействию между частицами системы. Системы с жидкой и газообразной дисперсионной средой: золи, суспензии, эмульсии, пены, пасты.
|
|
|
Методы получения коллоидных систем: диспергирование, пептизация и конденсация.
Молекулярно-кинетические свойства коллоидных систем. Диффузия. Первый закон Фика. Коэффициент диффузии и его зависимость от размера частиц (уравнение Эйнштейна). Особенности диффузии в коллоидных системах. Связь коэффициента диффузии со среднеквадратичным смещением частицы. Уравнение Эйнштейна-Смолуховского. Диализ и осмос. Проявления в природе и применение в технике. Особенности осмотического давления коллоидных систем.
Оптические свойства в дисперсных системах. Светорассеяние (опалесценция), флуоресценция. Уравнение Рэлея для светорассеяния, границы применимости и анализ уравнения. Приборы, основанные на светорассеянии - нефелометр и ультрамикроскоп. Поглощение света. Закон Бугера-Ламберта-Бэра и его применение в оптических методах анализа (фотоколориметрия и спектрофотометрия).
Двойной электрический слой (ДЭС) на границе раздела фаз. Механизм образования и строение ДЭС. Термодинамический и электрокинетический потенциалы, граница скольжения, толщина ДЭС. Влияние индифферентных и неиндифферентных электролитов на параметры ДЭС. Электрокинетические явления (электрофорез и электроосмос) и их практическое применение.
Устойчивость дисперсных систем. Агрегативная и кинетическая (седиментационная) устойчивость. Седиментация в дисперсных системах. Термодинамические и кинетические факторы агрегативной устойчивости. Физическая теория устойчивости и коагуляции - теория ДЛФО. Потенциальные кривые взаимодействия коллоидных частиц. Энергетический барьер и его значение для устойчивости. Взаимосвязь необратимой и обратимой агрегации частиц с параметрами потенциальных кривых взаимодействия. Структурообразование в пищевых и непищевых гетерогенных системах. Явление тиксотропии. Коагуляция коллоидных систем. Быстрая и медленная коагуляция. Влияние электролитов на величину энергетического барьера и коагуляцию. Правила коагуляции электролитами, порог коагуляции. Электростатический и неэлектростатические факторы устойчивости коллоидных систем.
|
|
|
Строение мицеллы. Зависимость состава мицеллы от условий получения коллоидного раствора.
Методические указания
Начните рассмотрение темы с основных понятий коллоидной химии: гетерогенная система, дисперсная фаза, дисперсионная среда, степень дисперсности.
Отметим, что при измельчении одного вещества, находящегося, например, в твердом состоянии, в другом, жидком или газообразном, можно получать частицы твердого вещества все меньшего и меньшего размера, распределенные в жидкости или газе. Процесс дробления одного вещества в другом называется диспергированием, а полученные в результате гетерогенные системы, состоящие из частиц одного вещества, распределенных в однородной среде другого, называются дисперсными системами.
Гетерогенные системы с частицами размером 10-5-10-7 называют коллоидными. Частицы коллоидных систем не видны визуально или в обычном микроскопе, так как они меньше длины волны видимого света. Для этих систем при сохранении гетерогенности характерно распределение частиц по всему объему. Частицы коллоидных систем состоят из большого числа молекул и являются отдельной фазой. Молекулы среды, в которой распределены коллоидные частицы, образуют другую фазу. Следовательно, всякая коллоидная система является гетерогенной и многофазной (как минимум двухфазной). Условием ее существования является нерастворимость вещества одной фазы в другой.
Обратите внимание на то, что степень раздробленности (дисперсность) коллоидных частиц определяет свойства дисперсных систем. Чем меньше размеры частиц, тем больше дисперсность.
|
|
|
Суспензии - грубодисперсные системы, диаметр частиц 10-4 см. частицы во взвешенном состоянии остаются недолго.
Повышение дисперсности до 10-5 см влечет за собой непрерывное хаотическое движение, благодаря чему они непрерывно диффундируют и являются кинетически устойчивыми - коллоидными системами. Чем меньше частицы дисперсной фазы, тем больше внутренняя поверхность между фазами, заметнее роль граничных слоев и поверхностных явлений.
Микрогетерогенные системы - частицы с размерами не менее 1мк. Это порошки, эмульсии, пены.
Порошки - сажа, мука, сухие краски, пигменты, цемент, мел, известь, лекарственные препараты. Порошки относятся и к микрогетерогенным системам и к коллоидам.
Резиновые смеси: дисперсная фаза - сажа, дисперсионная среда - каучук. Краски: дисперсная фаза - пигмент, дисперсионная среда - олифа.
Два метода получения порошков:
конденсационный: коагуляция золой коллоидов или в результате химических реакций:
Na2CO3 + CaCl2 → CaCO3↓ + NaCl.
дисперсионный: дробление исходного сырья и разделение на фракции путем рассева.
Все дисперсные системы делят на три группы исходя из агрегатного состояния дисперсионной среды:
1. Системы с газообразной дисперсионной средой.
Аэрозоли: твердое в газообразном (Т/Г) - дым, твердые частицы в газе (размеры частиц менее 10-5см). Аэрозоли - седиментационно-устойчивые - микрогетерогенные системы.
Дымы получают либо диспергированием, либо конденсированием. Диспергированием получают седиментационно неустойчивый дым.
Седиментационно устойчивые дымы получают в результате конденсационных процессов - конденсацией насыщенного пара (охлаждение или химический процесс). Условие конденсации - наличие центров конденсации - частиц или ионов.
Стабилизация аэрозолей - придание высокого электрического заряда - тогда частицы не слепляются при столкновениях.
Борьба с аэрозолями:
- механический способ: отделение дисперсной фазы от дисперсионной среды - фильтрация.
|
|
|
- электрический способ - электрофорез - электроосаждение при движении частиц в электрическом поле.
Туманы - жидкое в газообразном (Ж/Г), свойства аналогичны дымам.
Газ в газообразном (Г1/Г2)- неколлоидная система, так как она гомогенна.
2. Системы с жидкой дисперсионной средой.
Дисперсная фаза - твердое, дисперсионная среда - жидкость (Т/Ж) - коллоидные растворы золота, серебра, висмута, платины, олова, синтетические латексы.
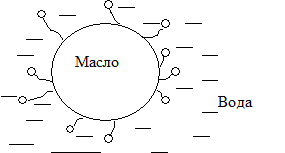
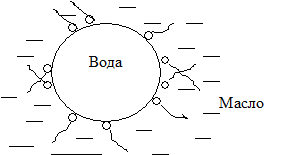
Ж1/Ж2 - эмульсии (молоко, масла, крема, мази, вода/нефть).
Г/Ж - эмульсии газов (пены).
Ж1/Ж2 - степень дисперсности - 10-3-10-5 см. это микрогетерогенные системы из двух несмешивающихся жидкостей. Одна из них диспергированна в другой в виде мелких капелек. Обычно одна из фаз - вода. Другую жидкость принято называть маслом. Для того, чтобы эмульсия была устойчивой необходим эмульгатор. Различают два типа эмульсии:
I тип. Дисперсная фаза - масло, дисперсионная среда - вода. М/В.
II тип. Дисперсная фаза - вода, дисперсионная среда - масло. В/М.
Как определить тип эмульсии?.
1. Эмульсию смешивают с водой. Если она смешивается с водой - тип I, если нет - тип II.
2. Электропроводность у типа I - высокая, у типа II
Получают эмульсии диспергированным перемешиванием в специальных приборах - мешалках и конденсационным методом (замена растворителя).
Эмульсии делятся на две группы:
- Эмульсии разбавленные - концентрация дисперсной фазы мала.
- Эмульсии концентрированные - концентрация дисперсной фазы значительна.
Наиболее часто встречаются эмульсии с объемной концентрацией более 1%. Они устойчивы лишь в присутствии эмульгатора.
| М/В - тип I Стабилизация: мылами (олеат натрия), белками | В/М - тип II Стабилизация: смолами (олеат Са2+ - поливалентный ион) |
|
|
Схема расположения молекул эмульгатора на капельках эмульсий.
Общее правило - эмульгатор имеет сродство с той жидкостью, которая является дисперсионной средой. С помощью эмульгатора получают до 99% эмульсий. Более 74% из них - желатинированные эмульсии - смазки, масло, маргарин, кремы, майонез. Твердые эмульгаторы - мел, глина, сажа.
Деэмульгирование. Химические методы - разрушение эмульгатора кислотой. Поверхностно-активные вещества не образуют прочных пленок.
В пенах (Г/Ж) дисперсионная среда вытянута в тонкие пленки. Концентрация дисперсной фазы (газа) велика, поэтому они подобны желатинированным эмульсиям. Существуют и твердообразные пены - пастила, суфле, мусс, изоляционные материалы. Пенообразователи: стабилизаторы мыла, ВМС - дающие пленки, окружающие пузырьки газа. При отвердении пленок образуются твердые пены - пенопласты, пенобетоны, микропористая резина. В пищевых пенах - желатин.
Суспензии - взвеси порошков в жидкостях. Они представляют собой микрогетерогенные системы, седиментационно-неустойчивые. Устойчивость появляется тогда, когда частицы покрыты сольватационными оболочками, состоящими из молекул дисперсионной среды. Для этого необходима хорошая смачиваемость частиц дисперсионной фазы. Гидрофильные порошки - CaCO3, BaSO4, Al2O3, сажа в бензоле.
3. Системы с твердой дисперсионной средой.
Т1/Т2 - сталь, чугун, сплавы, драгоценные камни, цветные стекла, черный алмаз.
Г/Т - пемза, туф, резины, пенопласт.
Ж/Т - вода в парафине.
Затем перейдите к рассмотрению свойств дисперсных систем. При этом начните с молекулярно-кинетических свойств. Молекулярно-кинетическая теория рассматривает коллоидные системы как частный случай истинных растворов. Это позволяет объяснить явление осмоса, диффузии, седиментационного равновесия и др. Нет качественной разницы между молекулярно-кинетическими свойствами коллоидных систем и истинных растворов. Молекулярно-кинетическая теория применима ко всем частицам, достаточно малым, чтобы принять участие в тепловом движении (размеры 10-4 см и меньше).
А) Броуновское движение.
Это движение выражается в том, что частицы дисперсной вазы под действием ударов молекул дисперсионной среды (среды, находящейся в постоянном молекулярно-тепловом движении) приходят в состояние хаотического движения. Характер движения частиц зависит от их размеров. Крупные частицы "танцуют" на месте, меньшие - совершают побеги в различные стороны, так как часть ударов молекул жидкости о коллоидные частицы оказываются некомпенсированными.
Б) Диффузия.
Если в коллоидной системе не выровнены концентрации, частицы, находящиеся в броуновском движении обнаруживают диффузионное перемещение, т.е. самопроизвольное выравнивание концентрация под влиянием беспорядочного теплового движения (консервирование, крашение тканей). Процесс диффузии всегда необратим и идет до полного выравнивания концентраций. Течение процесса обуславливается градиентом концентраций - степенью не выравненности - изменение концентрации на единицу расстояния.
Диффузия заканчивается наступлением равновесия - равномерного распределения молекул или частиц по всему объему системы.
Диффузия универсальна: наблюдается в истинных растворах, в коллоидных системах, гасовых смесях. Различия носят только количественный характер и выражаются в скоростях процесса, зависящих от величины и фоормы частиц. Коллоидные частицы диффундируют медленнее.
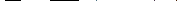 |
Скорость диффузии характеризуется первым законом Фика:
где dm - количество диффундирующего вещества, моль; dc/dx - градиент концентрации, т.е. изменение концентрации на единицу расстояния (величина, характеризующая степень невыравненности концентрации); S - площадь поперечного сечения, через которую диффундирует вещество; dt - время, сек; D - коэффициент диффузии.

Так как градиент концентраций выражается уменьшением концентрации, то ставят знак (-).
Скорость диффузии пропорциональная градиенту концентрации.
D - коэффициент пропорциональности, коэффициент диффузии.
 |
Физический смысл D. Если S=1, dτ =1, -dc/dx = 1, то D = dm, т.е. количеству вещества (в молях) диффундирующего в единицу времени через единицу площади при градиенте концентраций равном 1. D - это удельная скорость диффузии.
[D] = моль см см3/моль см2 сек = см2/сек.
 |
Используя уравнение Эйнштейна:
где R - универсальная газовая постоянная, N - число Авогадро, Т - температура, ή - вязкость, r - радиус частиц
можно найти размеры частиц.
В коллоидной системе D можно найти в результате наблюдения за броуновским движением.
В) Осмос.
Для коллоидных систем осмотическое давление очень мало., так как размеры частиц обычно на несколько порядков больше молекул и, следовательно, число частиц в единице объема коллоидного раствора в десятки и сотни тысяч раз меньше, чем в единице объема истинного раствора. Осмотическое давление пропорционально числу отдельных частиц, принимающих участие в молекулярно-тепловом движении, то есть числе молекул в единице объема:
p= nRT/N,
где n - числу молекул вещества в единице объема (n≈1/r3, где r - линейные размеры частиц), N - число Авогадро.
Г) Седиментация.
Седиментация заключается в свободном оседании частиц под действием силы тяжести, если плотность частиц больше, чем плотность жидкости. Таким образом, грубодисперсные системы седиментационно неустойчивы. Сила тяжести частиц (размером более 1 микрона), не принимающих участия в тепловом движении, не уравновешивается диффузией. Нарушается так называемое седиментационное равновесие и протекает седиментация - свободное оседание под действием силы тяжести.
Седиментационная устойчивость - устойчивость против оседания, связана с размером частиц.
Агрегатная устойчивость - устойчивость против сцепления, против коагуляции:
 |
где d1, d2 - плотности дисперсионной фазы и среды, η - вязкость, g - ускорение силы тяжести, r - размер частиц (r = C√v), С - постоянная Стокса.
Затем перейдите к рассмотрению электрических свойств коллоидных систем. Обратите внимание, что они обуславливаются составом и строением междуфазных адсорбционных слоев.
Электрофорез - движение частиц диспергированной фазы в электрическом поле к противоположно заряженному электроду.
Электроосмос - перенос жидкости относительно твердой стенки под влиянием внешней разности потенциалов.
Все явления движения фаз вдоль поверхности раздела, вызванные внешним электрическим полем или приводящие к возникновению электрического поля (потенциал течения, оседания) называются электрокинетическими явлениями.
Потенциал оседания - твердые частицы в жидкости направленно перемещаются под действием силы тяжести, ультразвука; потенциал течения - возникает при продавливании жидкости через пористую пробку, что способствует возникновению разности потенциалов.
Положительно заряженные частицы - гидроокиси железа, алюминия, хрома; красители; белки в кислой среде.
Отрицательно заряженные частицы - золи золота, серебра, платины, меди, сурьмы; сульфиды мышьяка, сурьмы, свинца; сера, мыло, крахмал, пектины, белки в щелочной среде.
Внутренний слой образован металлом, внешний слой - прилегающим слоем жидкости на постоянно малом расстоянии, равном радиусу сольватированного иона.
Внутренняя часть двойного слоя образована двумя рядами ионов, близко расположенных друг от друга:

Адсорбционный слой не является в целом электронейтральным, так как количество ионов второго ряда не совпадает с числом ионов первого ряда ввиду специфичности адсорбции ионов (-) и (+).
Недостающие заряды для компенсации потенциал определяющих ионов располагаются во внешней диффузной части двойного слоя, которая связана больше с жидкой фазой.

Диффузная часть двойного слоя подвижна, жидкая фаза - адсорбционная часть неподвижна. Разность потенциала этих фаз - электрокинетический потенциал ξ.
Электрические свойства коллоидов представляют большой практический интерес. Электрофорез применяют в лечебной практике для введения в организм лекарственных веществ, электроосмос используют для очистки дубленых кож, обезвоживания древесины.
Электрохимические явления основаны на представлении о двойном электрическом слое.
На границе раздела фаз возникает двойной электрический слой, так как происходит перераспределение электрического заряда при переходе заряженных частиц (ионов, электронов) из одной фазы в другую. Заряд одного знака образуется на поверхности одной фазы, другого - на другой поверхности.
Причины образования двойного электрического слоя:
1. переход катионов из металла в раствор. Механизм - ионы кристаллической решетки металла гидратируются водой и перейдут обратимо в раствор. На поверхности металла избыточные электроны, которые притягивают из раствора (+) катионы металла. На границе металл-раствор возникает равновесный двойной слой.
2. Соприкосновение двух несмешивающихся жидкостей: вода-масло.
3. Адсорбция на поверхности ионов из раствора.
Разберитесь в сущности следующих способов получения коллоидных растворов:
Диспергирование - дробление на мелкие частицы с помощью физического измельчения, ультразвука, электрического диспергирования постоянным и переменным электрическим полем..
Конденсация - создание условий для соединения мелких частиц коллоидной степени дисперсности (от 1 до 100 ммк).
Для достижения агрегативной устойчивости необходим еще стабилизатор, создающие защитный (адсорбционный) слой вокруг частиц.
Тонкоизмельченные вещества приобретают новые ценные свойства: лучшую красящую способность, яркость, утойчивость - краски; катализаторы - повышенную активность; продловольственные товары - лучшие вкусовые качества; белок, крахмал в раздробленном состоянии лучше растворяются в воде при комнатной температуре. При измельчении используется коллоидная мельница, которая изщмельчает до размера 1 - 0,1мк.
Эмульгаторы - жидкости, способные вытягиваться в тонкие пленки и нити, которые впоследствии распадаются на капельки.
Конденсация - выпаривание растворителя или замена его другим, в котором дисперсная фаза не растворима (духи в воде), охлаждение паров жидкости и твердых тел, сопровождающееся расширением или смешиванием с большим объемом воздуха (туман).
Химическая конденсация - химическая реакция, дающая осадок:
3Na2S2O3 + H2SO4 = 4S + 3Na2SO4 +H2O
золь
Пептизация - переход вещества осадка в коллоидный раствор под действием электролита. Электролит - пептизатор.
Fe(OH)3 + FeCl3 → коллоидный раствор красно-бурого цвета.
адсорбционная пептизация
Пептизаторы - ПАВ, скорость пептизации определяется концентрацией и химическими свойствами пептизатора, количеством осадака, температурой, перемешиванием, наличием ультразвука, радиоактивного облучения.
Диализ - очистка коллоидных растворов диффузией через полупроницаемые перегородки истинно и коллоидно растворенных веществ (желатин, целлофан, пергамент, керамика, иониты).
Электродиализ - перенос электрическим током ионов электролита к электродам.
Очищают диализом белки, дубящие вещества, красители. Диализ - вымачивание соленой рыбы, мяса, овощей и др. Электродиализ сыворотки сохраняет в ней протеины и лактозу.
Стабилизация. Коллоидные растворы термодинамически неустойчивы, так как обладают большим запасом свободной энергии. Существуют два вида устойчивости: кинетическая (седиментационная) и агрегативная.
Седиментационная устойчивость связана с диффузией и броуновским движением. Агрегативная - изменением степени дисперсности.
Слияние капелек в туманах, эмульсиях, пенах - коалесценизм - самопроизвольное уменьшение дисперсности.
Коагуляция - укрупнение частиц и нарушение агрегативной устойчивости под действием молекулярных сил притяжения.
Коагуляция подразделяется на скрытую и явную. При скрытой коагуляции на первой стадии еще не выпадает осадок, протекает быстро. На второй стадии протекает дальнейшая агрегация частиц и выпадение вещества в осадок - коагель или коагулят.
Коагуляцию могут вызвать электролиты и неэлектролиты, температура, механическое воздействие, свет, облучение, электрический ток. Особую роль играют электролиты.
Минимальная концентрация электролита, вызывающая быструю коагуляцию, называется порогом коагуляции и измеряется в молях/литр коллоидного раствора.
Коагулирующий ион должен иметь заряд, противоположный заряду частицы, что было установлено Гарди. Шульце ввел понятие коагулирующей способности - величине, обратной порогу коагуляции:
КС = 1/ПК
Правило Шульце-Гарди: с повышением валентности иона уменьшается концентрация добавляемого коагулирующего электролита.
Соотношение порогов коагуляции для одно-, двух-, трехвалентных ионов соответствует соотношению 100:10:1.
Исключение из правила: специфическая адсорбция, пептизация осадка, химическое взаимодействие с ионами двойного электрического слоя мицеллы (ионы водорода, тяжелые металлы, органические катионы - красители).
Стабилизировать коллоиды можно с помощью ПАВ, которые адсорбируясь на гранях зародышей осадка, изменяют их форму и замедляют рост. Это структурно-механическая стабилизация. С их помощью можно получать системы с очень большой устойчивостью. Защитное действие коллоидов играет большую роль в производстве пищевых изделий, лечебных препаратов, технических эмульсий. Золи защищенных коллоидов не следуют правилу Шульце-Гарди.
Коагуляция широко используется при очистке воды солями алюминия и железа - образуются коагели, захватывающие примеси. Большое значение имеют процессы коагуляции в маслосыродельной, пивоваренной, бродильной, кондитерской промышленности, хлебопечении.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 812; Нарушение авторских прав?; Мы поможем в написании вашей работы!