
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Главный белок внеклеточного матрикса - коллаген
|
|
|
|
14-12
Коллагены - это семейство весьма своеобразных фибриллярных белков, имеющихся у всех многоклеточных животных. Они секретируются главным образом клетками соединительной ткани и у млекопитающих занимают среди белков первое место по количеству, составляя около 25% всего белка. Характерная особенность молекул коллагена - их жесткая трехцепочечная спиральная структура. Три полипептидные цепи, называемые α-цепями (каждая примерно из 1000 аминокислот), скручены в одну регулярную суперспираль наподобие каната и образуют молекулу коллагена длиной около 300 нм и толщиной 1,5 нм. Коллагены содержат очень много пролина и глицина, которые оба играют
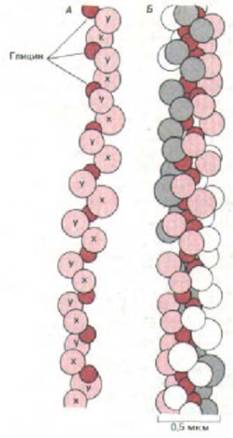
Рис. 14-32. А. Модель одной α-цепи коллагена, в которой каждая аминокислота представлена шариком. Цепь образует левозакрученную спираль с тремя аминокислотными остатками на один виток и с глицином (выделен темным цветом) в каждой третьей позиции. Таким образом, α-
цепь состоит из длинной серии триплетов Gly-X-Y, где X и Y могут быть любой аминокислотой (хотя обычно одна из них - пролин). Б. Модель участка молекулы коллагена, в которой три α-цепи скручены в спиральный жгут. Одна α-спираль выделена светло-красным цветом, другая - серым, а третья - белым. Глицин - единственная аминокислота, которая достаточно мала, чтобы помещаться в тесном осевом пространстве тройной спирали. Показана только небольшая часть молекулы; вся молекула достигает в длину около 300 нм, а каждая цепь состоит примерно из 1000
аминокислотных остатков. (Зарисовки с модели В. L. Trus.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
|
|
|
| Таблица 14-3. Четыре главных типа коллагена и их свойства | |||||
| Тип | Формула" | Полимерная форма | Отличительные черты | Местонахождение в организме | |
| I | 
| Фибрилла | Мало гидроксилизина, мало углевода, толстые фибриллы | Кожа, сухожилия, кость, связки, роговица, внутренние органы (составляет 90% всего коллагена в организме) | |
| II | 
| Фибрилла | Много гидроксилизина, много углевода, фибриллы тоньше, чем у типа I | Хрящ, межпозвоночные диски, хорда, стекловидное тело глаза | |
| III | 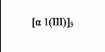
| Фибрилла | Много гидроксипролина, мало гидроксилизина, мало углевода | Кожа, кровеносные сосуды, внутренние органы | |
| IV | 
| Базальная мембрана | Очень много гидроксилизина, много углевода; сохраняет концевые пептиды проколлагена | Назальные мембраны | |
| 1) Обратите внимание, что в коллагенах I и IV два типа α-цепей, а в коллагенах Π и Ш-только один тип α-цепей. В таблице представлены только четыре главных типа коллагена, но сейчас известно более 10 типов коллагена и около 20 типов α-цепей. | |||||
важную роль в формировании трехцепочечной спирали. Пролин благодаря своей кольцевой структуре стабилизирует левозакрученную спиральную конформацию каждой a-цепи с тремя аминокислотными остатками на один виток. Глицин, наименьшая из аминокислот (вместо боковой цепи у нее только один атом водорода), повторяется на каждом третьем месте на протяжении всего центрального участка a-цепи; это дает возможность трем спиральным a-цепям плотно прилегать друг к другу с образованием законченной коллагеновой суперспирали (рис. 14-32).
До сих пор идентифицировано около 20 различных цепей коллагена, каждая из которых кодируется отдельным геном. В разных тканях экспрессируются различные комбинации этих генов. Хотя в принципе из таких двадцати a-цепей можно составить более 1000 видов трехцепочечных молекул коллагена, фактически было обнаружено только около 10 видов. Наиболее изучены типы I, II, III и IV (табл. 14-3). Типы I, II и III - фибриллярные коллагены. Это главные типы коллагенов, встречающихся в соединительных тканях, из них особенно широко распространен тип I. После того как молекулы этих трех типов коллагена переходят из клеток в межклеточное пространство, они организуются в упорядоченные полимеры, называемые коллагеновыми фибриллами. Это тонкие (толщиной 10-300 нм) канатовидные структуры длиной во много микрометров, ясно видимые на электронных микрофотографиях (рис. 14-33). Эти фибриллы часто группируются в более крупные пучки толщиной в несколько микрометров, которые видны уже в обычный микроскоп как коллагеновые волокна. Молекулы коллагена типа IV
|
|
|
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 14-33. Электронная микрофотография части фибробласта, окруженного коллагеновыми фибриллами, в соединительной ткани.
Сильно развитый гранулярный эндоплазматический ретикулум фибробласта отражает способность клетки к активному синтезу и секреции коллагена и других макромолекул внеклеточного матрикса. (С любезного разрешения Russell Ross.)
встречаются только в базальной мембране, вместо образования фибрилл они организуются в плоскую сеть, которая составляет значительную часть всей базальной мембраны (разд. 14.2.11). Как располагаются в тканях молекулы коллагена остальных типов, неясно.
Многие белки с повторяющимися последовательностями аминокислот возникли в результате дупликаций участков ДНК (разд. 10.5.4).
Именно так, видимо, появились и фибриллярные коллагены. Действительно, гены, кодирующие α-цепи таких коллагенов, очень велики (30-40
тысяч п. н.) и содержат около 50 экзонов. Большинство экзонов состоит из 54 или кратного 54 числа нуклеотидов, поэтому можно предположить, что эти коллагены возникли в результате множественных дупликаций первоначального гена, содержавшего 54 нуклеотида; сказанное не относится к коллагену типа IV, который, очевидно, возник другим путем.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 605; Нарушение авторских прав?; Мы поможем в написании вашей работы!