
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формы выражения результатов химического анализа воды
|
|
|
|
Чаще всего анализы воды проводятся на пробах, где общее количество растворенных твердых веществ составляет лишь небольшую долю одного процента от общего веса пробы воды. Поэтому минерализацию воды при проведении химического анализа удобнее выражать в частях на миллион, а не в процентах. Эта единица концентрации означает, что на 1 млн. весовых частей раствора приходится одна весовая часть растворенного вещества, например 1 кг растворенного вещества в 1 млн. кг воды или 1 т растворенного вещества в 1 млн. т воды. Ясно, что такая форма выражения концентрации вещества не зависит от единиц измерения. Другая мера концентрации раствора — 1 мг на 1 л — наиболее часто применяется в лабораторных исследованиях, когда проба воды измеряется в долях литра, а химические компоненты воды — в миллиграммах. Численно эти две единицы измерения концентрации — части на миллион и миллиграммы на литр — почти равны, если концентрация водного раствора низка, а удельный вес воды близок 1. В странах, где распространен английский язык, для выражения концентрации используется также мера граны на галлон. Соотношения перечисленных единиц измерения концентрации растворенных веществ в воде следующие:
части на миллион = миллиграммы на литр / удельный вес воды
1 % = 10 000 ч. на 1 млн.
1 гран на американский галлон = 17,12 мг/л
1 гран на имперский (британский) галлон = 14,3 мг/л
При геохимических исследованиях результаты анализа воды удобно выражать в эквивалентах на миллион, или, точнее, в миллиграмм-эквивалентах на килограмм воды, а также в миллиграмм-эквивалентах на литр. Концентрацию растворенного вещества в эквивалентах на миллион вычисляют делением количества этого вещества, выраженного в частях на миллион, на эквивалентный вес вещества. Эту единицу удобно использовать для химической характеристики воды; численно она представляет собой однотысячную долю химической величины, называемой нормальностью. Поскольку суммарно эквивалентные веса катионов и анионов в растворе должны быть одинаковы, сумму ионов в эквивалентах на миллион можно использовать для проверки точности и полноты химического анализа воды. Ниже приведены примеры пересчета результатов анализа воды в эквивалентную форму.
|
|
|
а. Пересчитать 63 ч. на 1 млн. Mg2+ в эквиваленты на 1 млн. Атомный вес Mg равен 24,32; валентность 2; эквивалентный вес = 24,32 / 2 = 12,16. Следовательно, 63 ч. на 1 млн. Mg2+ = 63 / 12,16 = 5,19 экв/млн.
б. Пересчитать 2,5 ч. на 1 млн. PO3-4 в эквиваленты на 1 млн. Атомный вес Р равен 30,97; атомный вес О равен 16; молекулярный вес РO4 равен 94,97; валентность 3; эквивалентный вес = 94,97 / 3 = 31,66. Следовательно, 2,5 ч. на 1 млн. PO3-4 = 2,5 / 31,66 = 0,079 экв/млн.
в. Проверить результаты анализа, выраженного в частях на 1 млн.: затабулировать содержание катионов и анионов в эквивалентах на 1 млн. и сравнить суммы катионов и анионов.
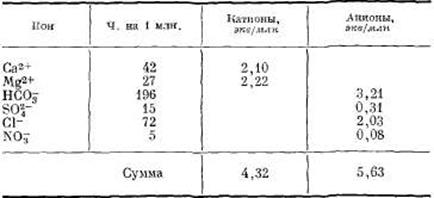
Поскольку суммы катионов и анионов не равны, анализ или неполон, или неправилен. Недостаточная величина суммы катионов, очевидно, объясняется тем, что в пробе воды не определены ионы Na+ и К+.
Кремнезем, различные взвеси и некоторые органические соединения присутствуют в воде в ионизированном состоянии. По этой причине их нельзя выразить в эквивалентной форме.
Многие химические анализы воды, производимые ранее, выражены в форме гипотетических солей CaCO3, MgCl2, NaCl и др., обнаруживаемых в сухом остатке после выпаривания. Эта форма выражения анализа имеет некоторые достоинства при изучении взаимосвязи воды и породы, однако еще существуют спорные положения касательно относительной растворимости этих соединений. В настоящее время редко выражают анализы воды в такой форме. Исключение составляет характеристика жесткости и щелочности воды с помощью СаСO3. Эти свойства воды выражаются определенным количеством углекислого кальция, растворенного в ней. Чтобы найти отдельно вес ионов А и В (в ч. на 1 млн.), входящих в соединение AnBm, используют следующие формулы:
|
|
|

Пример расчета. В данной пробе воды 32 ч. на 1 млн. СаСl2, Вычислить содержание иона Сl- в той же форме. Поскольку атомный вес хлора равен 35,5, а кальция 40, содержание иона Сl- равно (32)·(2·35,5/111) =20,5 ч. на 1 млн.
Химические анализы большого числа проб воды дают огромную информацию. Поэтому для выразительности результатов анализов составляют различные графики и карты. Наиболее приемлем метод построения карт пространственного изменения качества воды. Такова карта изолиний содержания хлоридов в воде, или карта изохлор (рис. 3.3). При составлении таких карт необходимо следить, чтобы на них не были сгруппированы данные, относящиеся к различным участкам без гидрогеологической связи. Иначе на карте, подобной изображенной на рис. 3.3, локальное высокое содержание хлоридов может означать загрязнение неглубоко залегающего водоносного горизонта, а также может относиться к глубокой скважине, почти не связанной с изучаемым водоносным горизонтом.

Рис. 3.3. Карты изохлор для различных глубин распространения подземных вод северной части долины Сан-Хоакип, штат Калифорния.
Изолиниями показано равное содержание хлоридов в подземных водах в частях на миллион. Видно изменение качества воды с глубиной, выраженной в футах. Расстояние между соседними линиями координатной сетки — 6 миль.
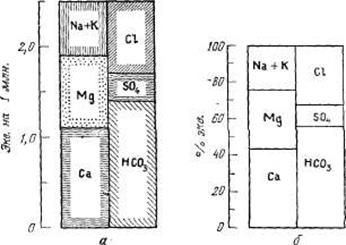
Рис. 3.4. Графики-колонки химического состава воды, выраженного: а — в эквивалентах на 1 млн. и б — процент-эквивалентах.
Для выражения химического анализа отдельных проб воды используются графики-колонки различных типов. На этих графиках химический состав воды обычно выражен в эквивалентах на 1 млн. или в процент-эквивалентах (рис. 3.4). Поскольку суммы эквивалентов анионов и катионов равны, две колонки таких графиков имеют одинаковые размеры. Для изображения состава воды применяют также диаграммы-круги и графики с радиальными координатами (рис. 3.5 и 3.6). На графике (рис. 3.7) результаты анализа воды выражены в продольных координатах. Такие диаграммы, носящие имя Стиффа, очень удобны для проведения быстрого качественного сравнения результатов большого числа химических анализов воды.
|
|
|

Рис. 3.5. Диаграмма-круг химического состава воды, приведенного на рис. 3.4.
Относительное содержание каждого иона в процент-эквивалентах определяется по длине дуги окружности. На радиусе показана сумма ионов в эквивалентах на 1 млн.
Описанные способы отображения результатов химических анализов воды ограничены тем, что результаты каждого анализа представляют самостоятельный график. Более эффективно наносить результаты анализа на график в соответствии с различными координатами. На рис. 3.8 показаны результаты анализов, нанесенные на двукоординатное поле. На рис. 3.9 изображен часто используемый график, известный под названием трехлинейной диаграммы. Этот график показывает содержание анионов и катионов на двух полях-треугольниках и общее положение всех основных ионов на поле-ромбе. Данные об анионах и катионах представлены в процентах от сумм главных ионов, выраженных в эквивалентах на 1 млн. Если необходимо нанести на график результаты небольшого количества анализов, то, как было отмечено выше, для этой цели используют графики-круги различных размеров.
Трехлинейные диаграммы, а также некоторые другие графики удобны для того, чтобы подчеркнуть различия и сходства вод разных типов. С помощью трехлинейных диаграмм можно показать факт смешения вод разной минерализации, потому что смесь двух химически различных вод на графике характеризуется прямой линией. Кроме того, если две группы данных сходятся на графике вдоль двух прямых к одной общей точке, можно определить общий источник ионов. Если концентрации различных компонентов оказываются в определенных соотношениях, смешение вод также возможно.
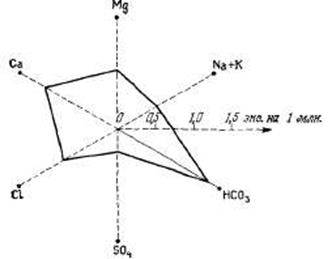
Рис. 3.6. График состава воды, показанного на рис. 3.4, а, в. радиальных координатах.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 979; Нарушение авторских прав?; Мы поможем в написании вашей работы!