
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальная часть. Экспериментальное определение общей жесткости воды проводят методом комплексонометрического титрования
|
|
|
|
Экспериментальное определение общей жесткости воды проводят методом комплексонометрического титрования, в основе которого лежит реакция комплексообразования между реагентом и катионами кальция и магния, содержащимися в анализируемой воде.
Титрантом является раствор динатриевой соли этилендиаминтетрауксусной кислоты (коммерческое название – трилон Б или комплексон III) – краткое обозначение Na2H2γ (рисунок 1). Этот раствор готовят на основе промышленно изготовленного фиксанала (стандарт–титра) и химически активной частицей в стандартном растворе является анион H2γ2–.
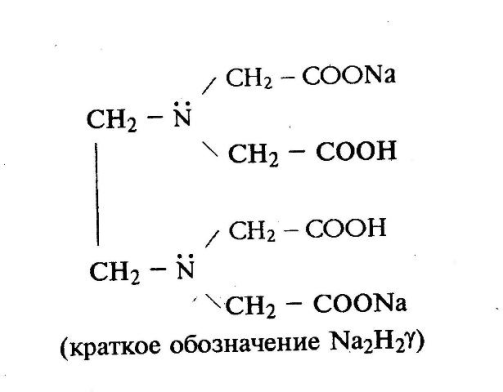

Рисунок 1 – Структурная формула трилона Б (слева) и пространственное строение комплексного соединения между катионами кальция и магния и анионом этилендиаминтетрауксусной кислоты (шестидентатный лиганд)
Для установления точки эквивалентности применяют металлоиндикатор эриохром черный Т – это трехосновная слабая органическая кислота, которую условно записывают в виде Н3Ind.
В зависимости от рН среды индикатор образует по-разному окрашенные анионы:
H3Ind  H2Ind–
H2Ind–  HInd2–
HInd2–  Ind3–
Ind3–
pH < 6,3 6,3-11,2 >11,2
красный синий желто-оранжевый
Кроме того, индикатор, в отличие от трилона Б, образует с катионами кальция и магния окрашенные комплексные соединения, но их прочность ниже, чем прочность комплексов с участием трилона Б. Индикатор вносят в исследуемую воду в твердом виде.
Суть определения жесткости воды в следующем. Аликвоту исследуемой воды переносят в колбу для титрования, к ней добавляют 5 мл аммиачного буферного раствора, имеющего рН = 9– 10, для стабилизации кислотности среды и далее на кончике шпателя вносят несколько крупинок твердого индикатора эриохрома черного Т. При данном значении рН индикатор находится в форме HInd2– и дает с частью катионов магния комплекс, придающий раствору винно-красную окраску:
|
|
|
 Mg2+ (вода) + HInd2– → MgInd– + H+
Mg2+ (вода) + HInd2– → MgInd– + H+
синий винно-красный
При титровании полученной смеси стандартным раствором трилона Б, сначала он реагирует со свободными ионами кальция и магния:
Ca2+ (вода) + H2γ2– → Саγ2– + 2 Н+
Mg2+ (вода) + H2γ2– → Mgγ2– + 2 Н+,
а на последнем этапе происходит разрушение менее устойчивого комплекса MgInd– с образованием более устойчивого комплекса Mgγ2–, причем полное исчезновение первого в точке эквивалентности сопровождается резким переходом окраски от винно-красной в синюю:
MgInd– + H2γ2– → Mgγ2– + HInd2– + H+.
винно-красный синий
Титриметрическую реакцию комплексообразования трилона Б с катионами кальция и магния можно рассматривать как ионообменную реакцию, которая сопровождается образованием двух ионов водорода, поэтому числа эквивалентности реагентов равны 2 и закон эквивалентов имеет вид:
[ c(1/2Са2+) + c(1/2Mg2+)] · Vал = с(1/2 Na2H2γ) · Vт,
откуда
Ж, ммоль/л = [ c(1/2Са2+) + c(1/2Mg2+)] ·103 =  · 103, (2)
· 103, (2)
где Vал и Vт – аликвота исследуемой воды и объем титранта, мл;
с(1/2 Na2H2γ) – молярная концентрация эквивалента трилона Б, моль/л.
Экспериментальное определение временной жесткости, обусловленной присутствием в воде гидрокарбонатов кальция Са(НСО3)2 и магния Mg(НСО3)2, связано с определением молярной концентрации гидрокарбонат- ионов НСО3–, поскольку каждому эквиваленту кальция 1/2Са2+ и магния 1/2Mg2+ соответствует анион НСО3–. С этой целью в колбу для титрования вносят аликвоту анализируемой воды Vал того же объема, что и при определении общей жесткости, добавляют несколько капель метилоранжа и титруют стандартным раствором хлороводородной кислоты до перехода окраски раствора от желтой к оранжево-красной:
НСО3– (вода) + НCl (титрант) → Н2СО3 + Cl–.
|
|
|
Закон эквивалентов
с(1/1 НСО3–) · Vал = с(1/1 НCl) · Vт,
откуда Ж(временная), ммоль/л= с(1/1 НСО3–) · 103 =  · 103. (3)
· 103. (3)
Последний результат позволяет рассчитать постоянную жесткость, связанную с присутствием в воде хлоридов, сульфатов, нитратов кальция и магния и др.:
Ж(постоянная) = Ж(общая) – Ж(временная) (4)
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 1527; Нарушение авторских прав?; Мы поможем в написании вашей работы!