
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С данными замечаниями согласен
|
|
|
|
Можете сравнить полученное значение с предыдущим расчетом.
Предыдущий расчет
CH4(г) + 2O 2(г) = CO2(г) + 2H2О(г).
Выписываем из справочника стандартные значения изобарно-изотермического потенциала при 25 °С:
| CO2(г) | H2O(г) | CH4(г) | О2(г) | |
| D G0, кДж/моль | -394,38 | –228,61 | –50,79 |
По следствию из закона Гесса определяем D H0 химической реакции

DG0 = (2D G 0 (H2О(г)) + D G 0 (CO2(г)) – (DG 0 (CH4(г)) + 2D G 0 (О2(г)) =
= (2· (–228,61) + (-394,38) –(–50,79 +0) = –800,81 кДж
Т.к. ΔG0 < 0, то реакция протекает в прямом направлении.
Расчет ΔG 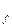 по требованию преподавателя
по требованию преподавателя
Для реакции CH4 (г) + 2 O2(г) = CO2(г) + 2 H2O(г)
Значения стандартных энтальпий образования и стандартных энтропий при 25 °С (данные справочника):
| Н2О (г) | CO2(г) | CH4 (г) | O2 (г) | |
| D H0, кДж/моль | -241,84 | -393,51 | – 74,85 | |
| S0, Дж/моль∙К | 188,74 | 213,6 | 186,19 | 205,03 |
1) Определяем D H0298 , химической реакции исходя из следствия из закона Гесса

DHх.р. = (2DH0 (Н2О (г) + DH0(СО2 (г)) – ((DH0 (CH4 (г)) + 2DH0 (O2 (г)))=
= (2· (–241,84) + (– 393,51)) – ((– 74,85) + 0) = –877,19 +74,85=
= –802,34 кДж/моль
2) Для определения DS0 вновь воспользуемся следствием из закона Гесса:

DSx.p. = (2 S0 (Н2О(г)) + S0 (СО2 (г))) – ((S0(CH4(г)) + 2S0 (O2(г))=
= (2· 188,74+ 213,6) – (186,19+ 2·205,03) =591,08 – 596,25 = –5,17 Дж/моль ·К
3) Изменение изобарно-изотермического потенциала определяем по формуле:
ΔGf = DH0 - ТDS0
ΔGf = –802,34 ·103– 298 (–5,17) = –800799,3Дж/моль = –800,8 кДж
Т.к. ΔG 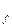 < 0, то реакция протекает в прямом направлении
< 0, то реакция протекает в прямом направлении
Задача 11.
Вычислите молярную массу эквивалента и эквивалент угольной кислоты в реакциях:
а) Н2СО3 + Mg(OH)2 = MgCO3 + 2Н2O;
б) 2Н2СО3 + СаСО3 = Са(НСО3)2 + Н2O:
в) Н2СО3 + 2КОН = К2СО3 + 2H2O.
Ответ:
а) H2CO3+Mg(OH)2=MgCO3+2H2O
В ходе реакции кислота образует две новые связи, поэтому
z = 2; fэ= 1/z = 1/2; Mэ = M·f = 62 ·1/2 = 31 г/моль
Эквивалент кислоты равен 1 поделенной на количество атомов водорода, отданных кислотой в ходе реакции. Значит, здесь эквивалент Н2СО3 равен 1/2.
|
|
|
б) 2H2CO3+CaCO3=Ca(HCO3)2+H2O
Одна молекула кислоты отдает один атом водорода в ходе реакции.
z = 1; fэ= 1/z = 1; Mэ = M·f = 62 ·1 = 31 г/моль
в) Н2СО3 + 2КОН = К2СО3 + 2H2O
1 моль Н2СО3 реагирует с 2 моль КОН, поэтому, эквивалент Н2СО3 равен 1/2, тогда
z = 2; fэ= 1/z = ½; Mэ = M·f = 62 ·1/2 = 31 г/моль
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 215; Нарушение авторских прав?; Мы поможем в написании вашей работы!