
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет термодинамических характеристик гальванических элементов
|
|
|
|
Так как
Электрическая проводимость растворов электролитов
Мерой способности веществ проводить электрический ток является эл ектрическая проводимость (L) – величина обратная электрическому сопротивлению проводника R:
 . (3.15)
. (3.15)
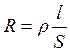 , (3.16)
, (3.16)
то
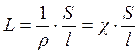 , (3.17)
, (3.17)
где ρ – удельное сопротивление, Ом·м (Ом·см);
S – поперечное сечение проводника, м2 (см2);
 – длина проводника, м (см);
– длина проводника, м (см);
 – удельная электрическая проводимость, Ом-1·м-1 (Ом-1·см-1).
– удельная электрическая проводимость, Ом-1·м-1 (Ом-1·см-1).
Удельная электрическая проводимость (χ – каппа) раствора – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1м2 (1 см2) и расположенными на расстоянии 1м (1 см) друг от друга.
Сопротивление раствора связано с удельной электрической проводимостью соотношением:
 , 3.18)
, 3.18)
где l – расстояние между электродами, S – поверхность электродов;  – постоянная измерительной ячейки.
– постоянная измерительной ячейки.
Если известна величина К, то по измеренному в данной ячейке сопротивлению раствора можно рассчитать значение удельной электрической проводимости:
 (3.19)
(3.19)
Постоянная измерительной ячейки К может быть найдена путем измерения в данной ячейке сопротивления (Rст .) электролита с известной удельной электрической проводимостью ( ) и расчета по следующей формуле:
) и расчета по следующей формуле:
К = Rст ∙  (3.20)
(3.20)
Эквивалентная (мольная) электрическая проводимость λv численно равна электрической проводимости такого объема V (м3, л, см3) раствора данной концентрации, в котором содержится 1г-экв (1 моль) растворенного вещества. Условно, это электрическая проводимость объема V раствора, заключенного между двумя параллельными электродами, с расстоянием между электродами 1м (1 см) и такой поверхностью, чтобы между электродами поместился объем раствора данной концетрации, в котором содержится 1г-экв (1моль) электролита.
|
|
|
Эквивалентная (мольная) электрическая проводимость и удельная электрическая проводимость связаны соотношением:
 . (3.21)
. (3.21)
Если концентрация выражена в г-экв/л (моль/л), а удельная электрическая проводимость в Ом-1 · см-1, то
 , (3.22)
, (3.22)
или с учетом (3.5):
 . (3.23)
. (3.23)
Эквивалентная электрическая проводимость при бесконечном разбавлении ( ) в соответствии с законом Кольрауша (законом независимого движения ионов) равна:
) в соответствии с законом Кольрауша (законом независимого движения ионов) равна:
 , (3.24)
, (3.24)
где 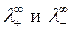 – эквивалентные электрические проводимости (электрические подвижности) катиона и аниона при бесконечном разведении; их значения приводятся в справочниках.
– эквивалентные электрические проводимости (электрические подвижности) катиона и аниона при бесконечном разведении; их значения приводятся в справочниках.
Степень диссоциации слабого электролита α и коэффициент электрической проводимости растворов сильных электролитов f (характеризует степень межионного взаимодействия) могут быть рассчитаны по формулам:
 (3.25)
(3.25)
 (3.26)
(3.26)
П р и м е р 3.4. Какой объем раствора электролита нормальной концентрации CN = 0,5 г-экв/л нужно условно залить в ячейку с электродами, расстояние между которыми 1 см, чтобы измеренная электропроводность была эквивалентной электропроводностью этого раствора?
Р е ш е н и е
Эквивалентная электропроводность – это электропроводность объема раствора, содержащего 1 г-экв электролита. В 1 л исходного раствора содержится 0,5 г-экв, поэтому
V = 1 /CN = 1/0,5 = 2 л/г-экв,
то есть следует условно залить 2 л раствора, чтобы в нем находилось нужное количество электролита – 1 г-экв..
П р и м е р 3.5. Рассчитать удельную и эквивалентную электрические проводимости раствора хлорида калия KCl с концентрацией 0,02 г-экв/л, если удельное сопротивление ρ составляет 354,61 Ом·см.
Р е ш е н и е
Найдем удельную электрическую проводимость:

Определим эквивалентную электрическую проводимость:

П р и м е р 3.6. Рассчитать эквивалентную электрическую проводимость раствора концентрации 0,075 г-экв/л, помещенного в ячейку с расстоянием между электродами 1,2 см и поверхностью каждого электрода 0,8 см2, если сопротивление раствора составляет 950 Ом.
|
|
|
Р е ш е н и е
Сопротивление раствора:
 ;
;
отсюда удельная электрическая проводимость:
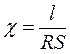 ;
;
 Ом-1· см-1
Ом-1· см-1  Ом-1· м-1.
Ом-1· м-1.
Зная  , рассчитываем эквивалентную электрическую проводимость:
, рассчитываем эквивалентную электрическую проводимость:
 ;
;
 ;
;

П р и м е р 3.7. Определить постоянную измерительной ячейки K, если раствор концентрации 0,005 г-экв/л имеет эквивалентную электрическую проводимость 400 Ом-1 ·г-экв–1 ·см2, а сопротивление этого раствора составляет 290 Ом.
Р е ш е н и е
Находим удельную электрическую проводимость раствора:

Сопротивление раствора:
 ,
,
отсюда
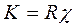 ;
;
 см-1.
см-1.
П р и м е р 3.8. Сопротивление раствора концентрации 0,015 г-экв/л составляет 1800 Ом. Постоянная измерительной ячейки равна 2,5 см-1. Рассчитать эквивалентную электрическую проводимость раствора.
Р е ш е н и е
По уравнению (3.19):

Находим эквивалентную электрическую проводимость:

П р и м е р 3.9. Определить степень диссоциации и константу диссоциации одно-одновалентного слабого электролита, если при разведении V = 16 л удельная электрическая проводимость раствора составляет 1,312·10-3 Ом-1см-1, а  232,6 Ом-1см2/г-экв.
232,6 Ом-1см2/г-экв.
Р е ш е н и е
Находим эквивалентную электрическую проводимость по уравнению (3.23):
 ;
;
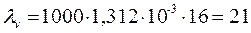 Ом-1см2/г-экв.
Ом-1см2/г-экв.
Находим степень диссоциации электролита по формуле (3.25):

Рассчитываем константу диссоциации по уравнению Оствальда (3.6):
 г-экв/л
г-экв/л
П р и м е р 3.10. Определить количество AgCl (г), содержащегося в 1 л раствора, если удельная электрическая проводимость насыщенного водного раствора AgCl составляет 1,259·10-6 Ом-1см-1. Подвижности ионов:  Ом-1см2/г-ион;
Ом-1см2/г-ион;  Ом-1см2/г-ион.
Ом-1см2/г-ион.
Р е ш е н и е
Так как хлорид серебра является малорастворимым соединением, то

Из уравнения:
 ,
,
может быть выражена концентрация раствора:

или в г/л: 
где 143,38 – эквивалент хлорида серебра, равный его молярной массе.
Гальванические элементы – это устройства, позволяющие получать постоянный электрический ток за счет окислительно-восстановительных химических реакций. Гальванический элемент состоит из двух электродов с различными электрическими потенциалами, возникающими на границе раздела твердой фазы (чаще всего металла) и жидкой фазы (раствора электролита). На одном из электродов происходит реакция восстановления (присоединение электронов), на другом – реакция окисления (отдача электронов). Например, в медно-цинковом гальваническом элементе Якоби-Даниэля на цинковом электроде, помещенном в раствор своей соли (например, ZnSO4), протекает процесс окисления цинка:
|
|
|
Zn ↔ Zn2+ + 2e-, (3.27)
на медном электроде, помещенном в раствор своей соли (например, CuSO4) – процесс восстановления ионов меди:
Cu2+ + 2e- ↔ Cu. (3.28)
Эти процессы пространственно разделены. Суммарная химическая реакция, за счет которой получается электрический ток в этом элементе:
Zn + Cu2+ ↔ Zn2+ + Cu. (3.29)
Эта химическая окислительно-восстановительная реакция является гетерогенной, поэтому константа равновесия для нее может быть записана следующим образом:
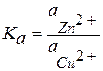 , (3.30)
, (3.30)
где 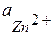 и
и  - активности потенциалопределяющих ионов Zn2+ и Cu2+ в растворах полуэлементов.
- активности потенциалопределяющих ионов Zn2+ и Cu2+ в растворах полуэлементов.
Гальванический элемент записывается таким образом, чтобы электрод, на котором происходит окисление (более электроотрицательный), находился слева. Например, медно-цинковый гальванический элемент может быть записан следующим образом:
Zn ê ZnSO4 êê CuSO4 ê Cu. (3.31)
Абсолютные значения потенциалов электродов неизвестны. Условные относительные потенциалы электродов (электродные потенциалы) рассчитываются по уравнению Нернста, которое в общем случае можно записать следующим образом:
 , (3.32)
, (3.32)
где  – активность окисленной формы потенциалопределяющих (участвующих в электродных реакциях) ионов;
– активность окисленной формы потенциалопределяющих (участвующих в электродных реакциях) ионов; 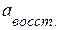 – активность восстановленной формы; z – количество электронов, участвующих в одном акте электродной реакции (для реакции (3.29) z =2); R – универсальная газовая постоянная (8,314 Дж/(моль·К)); F = 96485 ~ 96500 Кл/г-экв – постоянная Фарадея;
– активность восстановленной формы; z – количество электронов, участвующих в одном акте электродной реакции (для реакции (3.29) z =2); R – универсальная газовая постоянная (8,314 Дж/(моль·К)); F = 96485 ~ 96500 Кл/г-экв – постоянная Фарадея;  – стандартный электродный потенциал.
– стандартный электродный потенциал.
Если электрод представляет собой металл, опущенный в раствор своей соли, то:
 . (3.33)
. (3.33)
Так как активность чистых индивидуальных веществ (в данном случае, металла) равна 1, то уравнение для электродного потенциала электрода может быть записано в следующем виде:
|
|
|

 , (3.34)
, (3.34)
Стандартный электродный потенциал φо характеризует потенциал электрода при активностях потенциалопределяющих ионов, равных 1. Значения стандартных электродных потенциалов (соответствующих электродных реакций, записанных как реакции восстановления), приводятся в справочной таблице стандартных потенциалов (табл. 7.4). Они определены по отношению к стандартному водородному электроду, потенциал которого в выбранных стандартных условиях принят равным 0.
Электродвижущая сила ( ЭДС ) гальванического элемента (Е) – величина положительная и определяется как разность потенциалов положительного и отрицательного электродов:
Е = j(+) – j(–). (3.35)
Для рассмотренного гальванического элемента:
 . (3.36)
. (3.36)
Электродвижущая сила (ЭДС) гальванического элемента может быть рассчитана по уравнению Нернста:
 , (3.37)
, (3.37)
где  и
и  – активности потенциалобразующих ионов положительного и отрицательного электродов;
– активности потенциалобразующих ионов положительного и отрицательного электродов;
E0 – стандартная электродвижущая сила гальванического элемента – это ЭДС гальванического элемента при активностях потенциалобразующих ионов положительного и отрицательного электрода или их отношении, равных единице. Стандартная ЭДС равна разности стандартных электродных потенциалов положительного и отрицательного электродов:
 . (3.38)
. (3.38)
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1599; Нарушение авторских прав?; Мы поможем в написании вашей работы!