
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соотношение между единицами давления
|
|
|
|
| Единица | Па | кгс/м2 | ат(кгс/см2) | мм вод.ст | мм рт. ст. |
| 1 Па | 0,102 | 0,102 . 10-4 | 0,102 | 7,50 . 10-3 | |
| 1 кгс/м2 | 9,8 | 10-4 | 73,56 . 10-3 | ||
| 1 кгс/см2 | 9,8 .104 | 104 | 104 | 735,56 | |
| 1 мм вод.ст | 9,8 | 10-4 | 73,56 . 10-3 | ||
| 1 мм рт.ст | 133,32 | 13,59 | 13,59 | 13,59 |
Давление можно также измерять высотой столба жидкости (обычно ртути или воды). Техническая атмосфера соответствует 735,6 мм рт. ст. при температуре ртути 00 С или 10 м вод. ст. Так называемая физическая атмосфера (атм), или стандартное атмосферное давление, сохраняет свое значение и при пользовании системой СИ и соответствует 760 мм рт. ст. при температуре ртути 00С или 10332 мм вод. ст. В системе СИ давление измеряется в Па (1Па=1Н/м2).
Удельный объем вещества представляет собой объем, занимаемый единицей массы этого вещества.
υ = V/M, (5.2)
где υ – удельный объем, м3/кг; V – объем тела, м3; М – масса тела, кг.
При измерении температуры пользуются термометрами различных типов и двумя основными температурными шкалами: шкалой Цельсия и абсолютной (шкалой Кельвина). Связь между абсолютной температурой и температурой по шкале Цельсия выражается формулой:
T = t + 273, (5.3)
где Т – абсолютная температура, К; t – температура по шкале Цельсия, °С.
Для сравнения различных газов между собой по объему их приводят к так называемым нормальным физическим условиям (НФУ), характеризующимся давлением Р = 760 мм рт. ст. (101325 Па) и температуройt = 0°С (273 К).
Основные параметры газа связаны между собой функциональной зависимостью, называемой уравнением состояния:
F (P, υ, T) = 0. (5.4)
Наиболее простым уравнением состояния является уравнение Клапейрона для идеального газа:
РV = MRT, (5.5)
где Р – абсолютное давление газа, Па; V – объем газа, м3; М – масса газа,кг; R – газовая постоянная, Дж/(кг·К); Т – абсолютная температура, К.
|
|
|
Для 1 кг газа уравнение (1.5) имеет вид:
Pυ = RT, (5.6)
где υ – удельный объем, м3/кг.
Газовая постоянная R представляет собой физическую постоянную, которая для каждого газа принимает своё определенное значение, зависящее от природы газа и не зависящее от его состояния.
Уравнение (5.6) можно записать для 1 кмоль газа, умножая обе части уравнения на молекулярную массу µ:
pυμ = µRT или pVµ = µRT, (15.7)
где µ – молекулярная масса (число кг в 1 кмоль), (прил 3), кг/кмоль; Vµ – объем 1 кмоль, м3/кмоль; µR – универсальная газовая постоянная, Дж/(кмоль·К).
Универсальная газовая постоянная µR не зависит от состояния газа и одинакова для всех идеальных газов. Значение µR можно определить из уравнения (15.7), записывая его для НФУ (нормальных физических условий), при которых υμ любого идеального газа равен 22,4 м3/ кмоль (следствие из закона Авогадро):
µR = 8314 Дж/(кмоль·К).
Зная универсальную газовую постоянную µR, можно подсчитать газовую постоянную R, которую иногда, в отличие от универсальной,называют удельной:
 , Дж/(кг·К). (5.8)
, Дж/(кг·К). (5.8)
Пользуясь характеристическим уравнением для двух различных состояний, какого либо газа, можно получить выражение для определения любого параметра при переходе от одного состояния к другому, если значения остальных параметров известны:
 , (5.9)
, (5.9)
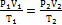 . (5.10)
. (5.10)
Уравнения (5.9) и (5.10) часто применяют для «приведения объема к нормальным условиям», т. е. для определения объема, занимаемого газом, при t = 00Cиp = 760 мм рт. ст., если объем его при каких-либо значениях P и t известен. Для этого случая уравнение (5.10) обычно представляют в следующем виде:
 (5.11)
(5.11)
В правой части уравнения все величины взяты при нормальных условиях, в левой – при произвольных значениях давления и температуры.
|
|
|
Уравнение (1.9) можно переписать следующим образом:
 ,
,
следовательно,
ρ2 = ρ1  , (5.12)
, (5.12)
где ρ1 и ρ2- плотности при двух состояниях вещества,кг/м3.
Уравнение (5.12) позволяет определить плотность газа при любых условиях, если значение его для определенных условий известно.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 769; Нарушение авторских прав?; Мы поможем в написании вашей работы!