
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные функции состояния рабочего тела
|
|
|
|
Газовые смеси
Под газовой смесью понимается смесь газов, не вступающих между собой в химические реакции. Составляющие смесь отдельные газыназываются компонентами. Каждый компонент смеси распространяетсяпо всему объему смеси.
Давление, которое имел бы каждый компонент, входящий в состав смеси, если бы он находился один в том же объеме и при той же температуре, что и смесь, называется парциальным давлением компонента (от латинского pars – часть).
По закону Дальтона давление смеси равно сумме парциальных давлений ее компонентов, т. е.:
Pсм = P1 + P2 + P3 +... + Pn =  , (5.13)
, (5.13)
где Рсм – давление газовой смеси; Р1, Р2, Р3, Рn – парциальные давления компонентов смеси.
Итак, каждый компонент смеси, занимая весь объем смеси, находится под своим парциальным давлением. Но если этот компонент поместитьпод давлением Рсм при той же температуре смеси Tсм, то он займет объемVi меньший, чем объем Vсм. Этот объем Vi называют приведенным илипарциальным.
Объем смеси равен сумме парциальных объемов ее компонентов:
V = V1 + V2 + V3 + … + Vn=  , (5.14)
, (5.14)
где V – полный объем смеси газов, м3; V1, V2, V3,…,Vn – парциальныеобъемы компонентов,м3, приведенные к условиям смеси, т. е. Рсм и Тсм.
Состав газовой смеси чаще всего задается массовым или объемным способом.
Массовая доля определяется отношением массы отдельного газа, входящего в смесь, к массе всей смеси:

где М1, М2, М3, …, Мn - масса отдельных газов, кг и М – масса всей смеси, кг.
Объемной долей газа называют отношение объема каждого компонента, входящего в смесь, к объему всей газовой смеси при условии, что объем каждого компонента отнесен к давлению и температуре смеси (приведенный объем):
|
|
|

где V1, V2, V3, …, Vn– приведенные объемы компонентов газов, входящих в смесь,м3;V – общий объем газовой смеси, м3.
Очевидно, что:
M1+M2+M3+…+Mn = M,
m1+m2+m3+…+mn = 1,
а также:
V1+V2+V3+…+Vn= V,
r1+r2+r3+…+rn = 1.
Для перевода массовых долей в объемные пользуются формулой:
 (5.15)
(5.15)
Перевод объемных долей в массовые производится по формуле:
 . (5.16)
. (5.16)
Плотность смеси определяется из выражения:
 (5.17)
(5.17)
или, если известен массовый состав, по формуле:
 , кг/м3. (5.18)
, кг/м3. (5.18)
Удельный объем смеси представляет величину, обратную ρсм, поэтому, если дан объемный состав смеси, то:
 (5.19)
(5.19)
Если же известен массовый состав, то:
 (5.20)
(5.20)
Из уравнения (5.17) легко получается значение так называемой кажущейся молекулярной массы газовой смеси:
 , (5.21)
, (5.21)
или через массовый состав:
 (5.22)
(5.22)
Таблица 5.2.
Формулы для расчёта газовых смесей
| Задание состава смеси | Перевод из одного состава в другой | Плотность и удельный объем смеси | Кажущаяся молекулярная масса смеси | Газовая постоянная смеси | Парциальное давление |
| Массовыми долями |

| 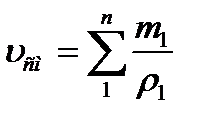
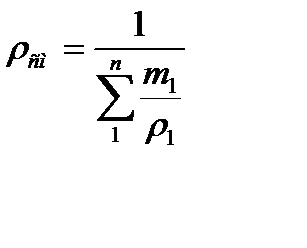
|

|

|
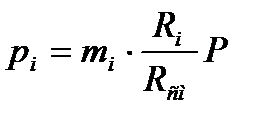
|
| Объемными долями |

|
 
|

|

|

|
Газовую постоянную смеси газов (Rсм) можно выразить либо через газовые постоянные отдельных компонентов, входящих в смесь, либо через кажущуюся молекулярную массу смеси:
 (5.23)
(5.23)
или:
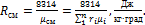 (5.24)
(5.24)
Связь между давлением газовой смеси и парциальными давлениями отдельных компонентов, входящих в смесь, устанавливается следующей зависимостью (закон Дальтона), легко получаемой из основного уравнения кинетической теории газов:
 , (1.25)
, (1.25)
где P – общее давление газовой смеси;p1, p2, …, pn – парциальные давления отдельных компонентов, входящих в смесь.
Парциальные давления определяются проще всего, если известны объемные доли отдельных компонентов, входящих в смесь:
|
|
|
 ,
,
или вообще:
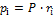 . (1.26)
. (1.26)
где pi – парциальное давление любого газа, входящего в смесь.
В табл. 1.2 дана сводка формул, применяемых при расчетах газовых смесей.
1.3. Теплоёмкость газов
Теплоемкостью (точнее удельной теплоемкостью) называют количество теплоты, которое необходимо сообщить телу (газу), чтобы изменить температуру какой-либо количественной единицы на 1°С (1К).
Количество теплоты в системе СИ измеряют в Дж или кДж. В зависимости от количественной единицы вещества различают массовую теплоемкость С – кДж/(кг·К), объемную теплоемкость С’–кДж/(м3·К) и киломольнуютеплоемкостьμС– кДж/(кмоль·К).
Поскольку в 1 м3 в зависимости от параметров состояния содержится различная масса газа, то объемную теплоемкость всегда относят к 1 м3 газа при нормальных условиях (РН = 760 мм рт. ст., tН = 0°С).
Массовая, киломольная и объемная теплоемкости связаны между собой следующими зависимостями:
 (1.27)
(1.27)
где μ– молекулярная масса или количество кг в киломоле данного вещества, кг/кмоль;
 (1.28)
(1.28)
где 22,4 – объем киломоля любого идеального газа в нормальных физических условиях (следствие из закона Авогадро), м3н /кмоль;
C’= С·ρн, (1.29)
где ρН – плотность данного вещества при нормальных условиях, кг/м3н.
Теплоемкость идеальных газов зависит от атомности, характера процесса и температуры.
Теплоемкость реальных газов, кроме перечисленных выше факторов, зависит еще и от давления. Зависимость теплоемкости от температуры обычно выражают формулой:
C= a+ bt+ et2, (1.30)
где t–температура в°С; a, b, е–численные коэффициенты, определяемые экспериментально.
Аналогичные зависимости получены не только для массовых, но и для других видов теплоемкости (объемных, киломольных).
Различают среднюю и истиннуютеплоемкости.
Средняятеплоемкость в интервале температур t1 – t2 равна:
 , (1.31)
, (1.31)
где q1-2 – количество теплоты, подведенное в данном процессе, кДж/кг;
t1, t2 – температура в начале и в конце процесса, °С.
Если выражение (1.31) записать для бесконечно малого количества теплоты dq и интервала температур dt, то получим формулу так называемой истинной теплоемкости С при данной температуре:
|
|
|
 . (1.32)
. (1.32)
Из выражения (1.32) dq = Cdt, а для всего процесса 1–2 количество теплоты q1-2 будет равно:
 . (1.33)
. (1.33)
Это же количество теплоты можно выразить через среднюю теплоемкость, что следует из (1.31):
 . (1.34)
. (1.34)
Имеется еще одна формула для подсчета q1-2:
 . (1.35)
. (1.35)
Применение этого выражения удобно при наличии таблиц средних теплоемкостей  .
.
В некоторых случаях требуется, пользуясь таблицами средних теплоемкостей  , определить значение теплоемкости
, определить значение теплоемкости  . Для этого из(1.34) и (1.35) можно получить формулу:
. Для этого из(1.34) и (1.35) можно получить формулу:
 . (1.36)
. (1.36)
В теплотехнике особое значение имеют два случая нагревания (охлаждения): при постоянном давлении (изобарный процесс) и припостоянном объеме (изохорный процесс). Обоим этим случаямсоответствуют изобарные и изохорные теплоемкости, имеющие вобозначениях индексы «p» «v».
Изобарные теплоемкости: 
Изохорные теплоемкости: 
Между теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость:
-для массовых теплоёмкостей:
 , (1.37)
, (1.37)
-для мольных теплоемкостей:
 .(1.38)
.(1.38)
Для приближенных расчетов и при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл. 1.3).
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемое буквой k и называемое показателем адиабаты:
 . (1.39)
. (1.39)
Принимая теплоемкость постоянной, на основании данных табл. 1.3 можно получить для одноатомных газов k=1,67; длядвухатомных газов k=1,4; для трехатомных газовk=1,29.
Таблица.1.3.
Приближенные значения киломольных теплоемкостей газов при постоянном объеме и постоянном давлении (C = const)
| Газы | Теплоемкость в кДж/(кмоль·К) | |
| µСv | µCp | |
| Одноатомные | 12,56 | 20,93 |
| Двухатомные | 20,93 | 29,31 |
| Трех - и многоатомные | 29,31 | 37,68 |
Если в процессе участвуют М кг или Vнм3 газа, то подсчет количества тепла производится по формулам:
 , (1.40)
, (1.40)
и:
 . (1.41)
. (1.41)
Теплоемкость газовой смеси определяется на основании следующих формул:
массовая теплоемкость смеси:
|
|
|
 (1.42)
(1.42)
oбъемная теплоемкость смеси:
 (1.43)
(1.43)
мольная теплоемкость смеси:
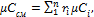 (1.44)
(1.44)
где i – номер компонента смеси; n – число компонентов смеси.
В этих выражениях mi, ri – соответственно массовая и объемная доля i-го компонента газовой смеси;  ,
,  ,
, 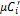 – соответственно массовая, объемная и мольная теплоемкость i-го компонента;
– соответственно массовая, объемная и мольная теплоемкость i-го компонента;  ,
,  ,
,  – соответственно массовая, объемная и мольная теплоемкость газовой смеси.
– соответственно массовая, объемная и мольная теплоемкость газовой смеси.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 838; Нарушение авторских прав?; Мы поможем в написании вашей работы!