
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристики основных термодинамических процессов идеального газа
|
|
|
|
Второй закон термодинамики
Второй закон термодинамики определяет направление, в котором протекают процессы, устанавливает условия преобразования тепловой энергии в механическую, а также определяет максимальное значение работы, которая может быть произведена тепловым двигателем.
Второй закон термодинамики математически может быть выражен следующим образом:
 (1.117)
(1.117)
Таблица. 1.5
| Характеристика процесса | Название процесса | ||
| Изохорный | Изобарный | Изотермический | |
| Показатель политропы | ∞ | ||
| Уравнение процесса | V=const; P/T=const | P=const; V/T=const | T=const; PV=const |
| Теплоемкость. кДж/(кг·К) | Cv | Сp=Cv+R | ∞ |
| Изменение внутренней энергии ∆u1-2=u2-u1 (кДж/кг) | Сv(Т2-Т1) | Сv(Т2-Т1) | |
| Изменение энтальпии ∆h1-2=h2-h1 (кДж/кг) | Cp(Т2-Т1) | Сp(Т2-Т1) | |
| Изменение энтропии ∆s1-2=s2-s1 (кДж/кг) | CvlnТ2/Т1 | Сpln Т2/Т1 | 
|
| Количество теплоты q1-2 (кДж/кг) | Cv(Т2-Т1) | Сp(Т2-Т1) | 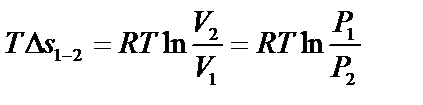
|
| Работа изменения объема l1-2 (кДж/кг) | P(V2-V1)=R(T2-T1) | 
| |
| Работа техническая l’1-2 (кДж/кг) | -V(Р2-Р1)=v(P1- P2)= =R(T1-T2) | l’1-2= l1-2= q1-2= = 
|
Продолжение табл. 1.3.
| Характеристика процесса | Наименование процесса | |
| Адиабатный | Политропный | |
| Показатель политропы | k= Сp/Сv | 
|
| Уравнение процесса | РVk=const | РVn=const |
| Теплоемкость. кДж/(кг·К) | 
| |
| Изменение внутренней энергии ∆u1-2=u2-u1 (кДж/кг) | Сv(Т2-Т1) | Сυ(Т2-Т1) |
| Изменение энтальпии ∆h1-2=h2-h1 (кДж/кг) | Сp(Т2-Т1) | Сp(Т2-Т1) |
| Изменение энтропии ∆s1-2=s2-s1 (кДж/кг) | 
| |
| Количество теплоты q1-2 (кДж/кг) | 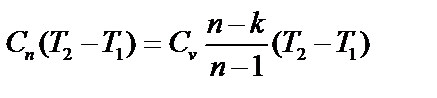
| |
| Работа изменения объема l1-2 (кДж/кг) | 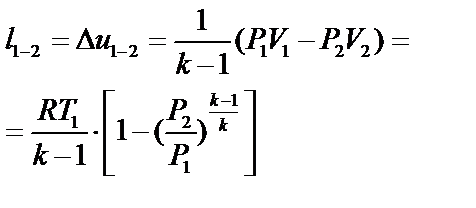
| 
|
| Работа техническая l’1-2 (кДж/кг) | 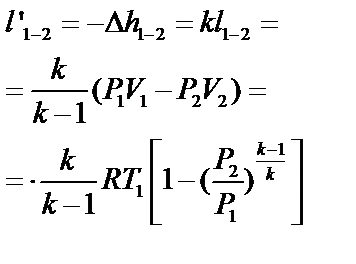
| 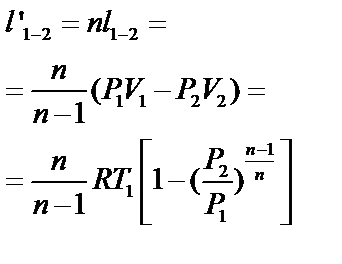
|
где dS – бесконечно малое приращение энтропии системы;dQ – бесконечно малое количество тепла, полученного системой от источника тепла;T – абсолютная температура источника тепла.
|
|
|
Знак неравенства соответствует необратимым процессам, а знак равенства – обратимым процессам. Следовательно, аналитическое выражение второго закона термодинамики для бесконечно малого обратимого процесса имеет вид:
 (1.118)
(1.118)
а так как согласно первому закону термодинамики:
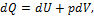
то уравнение (1.118) принимает следующий вид:

ЭНТРОПИЯ ИДЕАЛЬНОГО ГАЗА
Основным уравнением для определения изменения энтропии в обратном процессе является выражение:
 (1.119)
(1.119)
Поскольку в технической термодинамике приходится иметь дело не с абсолютным значением энтропии, а с ее изменением, отсчет значений энтропии можно вести от любого состояния. Для газов принято считать значение энтропии равным нулю при нормальных условиях, т. е. при t = 0oC и P = 760 мм.рт. ст.
Определение энтропии для любого состояния газа при постоянной теплоемкости, отсчитанной от нормального состояния, производят по следующим формулам:
 (1.120)
(1.120)
 (1.121)
(1.121)
 (1.122)
(1.122)
Изменение энтропии между двумя произвольными состояниями газа 1 и 2 при постоянной теплоемкости определяют по следующим формулам:
 (1.123)
(1.123)
 (1.124)
(1.124)
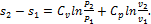 (1.125)
(1.125)
Уравнения кривых различных термодинамических процессов в системе координат Ts имеют следующий вид (при постоянной теплоемкости):
уравнение изохоры:
 (1.126)
(1.126)
уравнение изобары:
 (1.127)
(1.127)
Взаимное расположение изохоры и изобары показано на рис. 1.7.

Рис. 1.7. Взаимное расположение изохоры и адиабаты в координатных
осях TS
уравнение изотермы:
T = const.
При этом изменение энтропии в изотермическом процессе равно:
 (1.128)
(1.128)
Уравнение адиабаты:
s = const. (1.129)
Изображение изотермы и адиабаты в системе координат TS и Pυ дано соответственно на рис. 1.8 и 1.9.
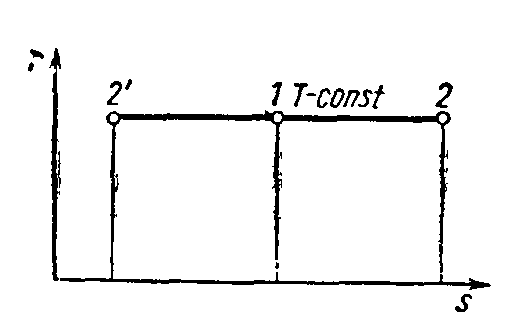
Рис. 1.8. Изображение изотермы в координатных осях TS
|
|
|

Рис. 1.9. Изображение адаибаты в координатных осях Pυ
Уравнение политропы:
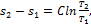 (1.130)
(1.130)
где:

Широким распространением при решении термодинамических задач пользуется диаграмма TS. Адиабаты в этой диаграмме изображаются вертикалями, изотермы – горизонталями, изохоры и изобары идеального газа – логарифмическими кривыми.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1266; Нарушение авторских прав?; Мы поможем в написании вашей работы!