
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Как же горит топливо
|
|
|
|
Горение любого топлива это процесс химической реакции окисления определенных веществ, сопровождающийся выделением тепловой энергии. В природе не так много химических элементов, которые при окислении выделяют энергию. К ним, прежде всего, относятся углерод, водород, сера, азот и их соединения.
Всякое топливо проходит цепочку технологических операций от момента добычи до выхода из котла тепловой электростанции в виде продуктов сгорания. Физико-химические преобразования его сопровождаются получением определенного количества энергии и выходом прогнозируемого количества различных газов, твердого шлака и золы (рис. 2.1).
Типичные экзотермические реакции горения топлива связаны с процессами окисления различных химических элементов. В табл. 2.6 представлены такие реакции, проходящие с тепловым эффектом. Там же даны количественные характеристики, как самих химических элементов, так и энергетических результатов реакций. Как видно из табл. 2.6, основными продуктами реакций являются углекислый газ СО2 и водяной пар Н2О, при соединении которого с окислами серы, азота и углерода образуются кислоты. Помимо вышеперечисленных реакций, идут реакции с образованием  из азота, находящегося в топливе и в воздухе, привлекаемом к процессам окисления. Сера в топливе может быть не только в чистом виде, но и в составе колчедана
из азота, находящегося в топливе и в воздухе, привлекаемом к процессам окисления. Сера в топливе может быть не только в чистом виде, но и в составе колчедана 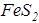 и сульфата (например,
и сульфата (например,  ), который может образовываться из реакции с карбонатами при температурах
), который может образовываться из реакции с карбонатами при температурах 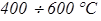 . При t > 1000 0С сульфаты, в свою очередь, разлагаются до окислов серы и кальция. Колчедан при
. При t > 1000 0С сульфаты, в свою очередь, разлагаются до окислов серы и кальция. Колчедан при  >400 0C окисляется с образованием окислов серы и железа.
>400 0C окисляется с образованием окислов серы и железа.
|
|

Рис.2.1. Физико-химические преобразования твердого (а), жидкого и газообразного (б) топлива
|
|
|
Сложнее всего горит твердое топливо. В отличие от газообразного и жидкого твердое топливо несжимаемо. В процессе всего горения частицы твердого топлива не только не расширяются, но наоборот уменьшают свой объем. Поэтому, чтобы увеличить поверхность соприкосновения твердых горючих частиц с окислителем, твердое топливо приходится тщательно измельчать в специальных мельницах. Температура воспламенения большинства углеводородов равна 100¸2500С (табл.2.2), в то время как для коксового остатка, являющегося основой горения большинства углей, температура воспламенения не менее 7500С. Отсюда возникает необходимость более детально проанализировать возможности воспламенения и горения твердых топлив и, особенно, низкореакционных топлив.
Таблица 2.6
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 62; Нарушение авторских прав?; Мы поможем в написании вашей работы!