
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методов аналитических исследований
|
|
|
|
Исследований
Классификация методов аналитических
Основные характеристики аналитических методов
В основе классификации и оценки аналитических методов исследований положены следующие характеристики:
1. Вид анализа – качественный, количественный и структурный. Качественный анализ – это идентификация состава вещества, определение атомов, ионов, молекул и радикалов в исследуемом материале. Количественный анализ – определение количественного соотношения между компонентами пробы или концентрации какого-либо вещества. Структурный анализ – выявление взаимного расположения атомов и молекул вещества в пространстве.
2. Степень избирательности, специфичности или селективности метода. Высокоизбирательные методы определяют наличие конкретного вещества в средах сложного состава с близкими характеристиками различных компонент.
3. Количество вещества, отбираемого для пробы, часто определяет выбор метода. Существуют макропробы – 0,5-10г, полумикропробы – 0,01-0,5г, микропробы – 0,001-0,01г и ультрамикропробы менее 0,001г.
4. По наличию точной математической зависимости между сигналом на выходе анализатора и концентрацией вещества – подразделяют на абсолютные, у которых такая зависимость есть, и относительные, для которых исследователь сам в фиксированных условиях конкретного эксперимента устанавливает соотношение между величиной аналитического сигнала и концентрацией вещества. Вторых большинство, часто используют метод градуировочного графика.
5. Свойство вещества, лежащее в основе метода, определяющее тип измерительного эффекта, в результате которого фиксируется физический показатель, связанный со свойством или компонентом исследуемой пробы.
|
|
|
Свойства биологических веществ очень разнообразны, отсюда и разнообразие методов. Выше все аналитические методы были нами разделены на три группы – физико-химические, химические и биологические, дано кратко их описание. С инженерной точки зрения нас больше интересуют физико-химические методы. Их подробная классификация приведена в приложении. В следующей главе рассмотрим их основные характеристики и области применения.
Рассмотрим методы, входящие вфизико-химическую группу, которые основаны на физических и физико-химических свойствах компонентов пробы. В этих методах с помощью соответствующею анализатора непосредственно измеряют физические параметры вещества исследуемой пробы, связанные некоторой зависимостью со свойством биопробы или концентрацией интересующего нас компонента.
Если воспользоваться критерием классификации методов аналитических исследований по характерному физическому свойству анализируемого компонента, то основные методы физико-химической группы можно также разбить на несколько подгрупп [4]: механические, электрохимические, миграционные и методы, в основе которых лежит взаимодействие излучения с веществом или анализ собственных излучений вещества (см. прил.). В отдельную подгруппу также следует выделить аналитические методы, основанные на сложных, в частности, двойных эффектах, в которых измерительный сигнал формируется при наличии более чем одного воздействия [I]. Однако такие методы в основном используются при научных исследованиях и редко применяются в клинических лабораториях. Дадим краткую характеристику каждойиз перечисленных подгрупп.
1. Механические методы, основаны на измерении параметров механических свойств вещества. В практике лабораторного анализа наибольшее распространение получили методы измерения:
|
|
|
- объемов, плотности, удельного веса;
- вязкости, эластичности, силы поверхностного натяжения;
- массы и механических свойств дисперсионных фаз;
- параметров движения частиц биожидкости в гравитационных и других полях;
- параметров распространения звука и ультразвука в биосредах.
Основными методами физико-механических исследований являются:
– валюмометрия;
– объемная монометрия;
– осмометрия;
– весометрия;
– вискозиметрия;
– эластометрия;
– седиментационный анализ;
– мембранная фильтрация;
– УЗ анализ;
– поверхностного натяжения.
Валюмометрия – измерение объемных параметров биожидкости. С ее помощью изучается взаимодействие веществ в биожидкости по зависимости свойств равновесных систем от их состава. Исследуется мольный объем жидких смесей, который определяется как отношение молярной массы к плотности вещества  . По полученным значениям мольного объема V строятся изотермы, по ним определяется наличие того или иного вещества.
. По полученным значениям мольного объема V строятся изотермы, по ним определяется наличие того или иного вещества.
Использование валюмометрии в клинико-лабораторных исследованиях направлено:
– на определение мольных объемов;
– построение и исследование изотерм;
– регистрация выходных химических реакций;
– для определения поверхностного натяжения жидких сред и упругих паров.
Объемная монометрия – метод численного определения осмотического давления (давление на раствор, отделенный от чистого растворителя полунепроницаемой мембраной).
В основе действия всех монометрических проборов лежит уравнение состояния Менделеева–Клапейрона
 , где
, где 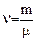 .
.
Объемная монометрия используется для анализа газов, образующихся при химических превращениях биожидкости.
Монометрические газоанализаторы регистрируют химический выход реакции при постоянном давлении и температуре.
Волюмометрические газоанализаторы измеряют объем газа при постоянном давлении и температуре.
Осмометрия делится:
– на статическую мембранную – измерение равновесной среды и разности давлений в этой среде по обе стороны мембраны путем измерения высоты столба растворителя, проникающего в раствор;
– динамическую – измерение мгновенного давления, приложенного к раствору, способного препятствовать притоку растворителя в исследуемый раствор.
|
|
|
Весометрия – метод определения веса биожидкости как гетерогенного (находящегося в различной фазе состояния) биовещества.
Вискозиметрия – определяет вязкость жидкости на основе гидродинамической теории. Измеряет вязкость гетерогенных жидкостей путем построения изотермы вязкости, изучает слабое взаимодействие двух и трех систем жидкости.
Вязкость биожидкости определяется в основном содержанием в клеточных и в высокомолекулярных соединениях биожидкости. Для сложных биожидкостей и систем биожидкостей вязкость может быть определена соотношением Эйнштейна–Ванда  , где
, где  – скорость перемещения слоев включений; r – вязкость среды; Q – параметр взаимодействия различных включений; C – концентрация включения; A – коэффициент, определяемый формами включений.
– скорость перемещения слоев включений; r – вязкость среды; Q – параметр взаимодействия различных включений; C – концентрация включения; A – коэффициент, определяемый формами включений.
Методы измерения вязкости:
– ротационная вискозиметрия;
– капиллярная вискозиметрия;
– вискозиметрия падающего шарика.
Если применение этих трех методов невозможно, то пользуются калибровочными жидкостями с известным значением вязкости.
Седиментационный анализ делится на седиментацию (осаждение) и флотацию (всплытие). Его разновидность – реакция оседания эритроцитов (оседание частиц под действием малой тяжести без дополнительного ускорения).
Мембранная фильтрация – метод предварительной подготовки биопробы для анализа, реже для определения дисперсного состава низкодисперсионных аэрозолей. Для фильтрации используются тканевые и бумажные фильтры с известным размером фильтрующей ячейки. Набор фильтрующих элементов позволяет производить порционный анализ биожидкости (разделение по фракциям белка). Может осуществляться в простом гидростатическом поле и с повышенным градиентом.
Акустические методы исследования биожидкости основаны на особенностях распространения ультразвуковых волн в биожидкости, которые могут быть использованы для определения состава биожидкости и молекулярных процессов в жидких средах. Параметры поглощения и дисперсии ультразвука могут быть использованы для оценки молекулярно-кинетических свойств жидкости и ее структуры. Методы ультразвукового анализа построены на разделении жидких и твердых дисперсных фаз в стоячих волнах. Ультразвуковая коагуляция – образование из одиночных частиц агрегатов (обратный процесс – диспергирование). Ультразвуковая фильтрация основана на совмещении мембранной фильтрации с ускоряющим воздействием колебаний на процесс.
|
|
|
Методы поверхностного натяжения используют в качестве диагностической величины поверхностное натяжение различных биологических сред, которое может являться чувствительной мерой поверхностно-активных веществ. Поверхностное натяжение определяется работой, затраченной на процесс образования поверхности раздела двух равновесных фаз.
2. Электрохимические методы основаны на измерении параметров электрических свойств вещества (электрической проводимости, потенциала, сопротивления, количества электричества). Методы данной группы, как правило, базируются на взаимодействии молекул вещества пробы с электронами на поверхности электродов с последующим образованием ионов (реакции окисления и восстановления). Методы, связанные с регистрацией электрических характеристик исследуемого объекта, позволяют кодировать информацию о свойствах вещества непосредственно в форме электрического сигнала, наиболее удобной для последующею преобразования. В этой подгруппе представлен широкий диапазон методов, с помощью которых удается определять различные неорганические и органические соединения, ферментативную и иммунную активность, белковый состав, проводить дисперсионный анализ суспензий и т. п. Общая черта, объединяющая электрохимические методы в одну подгруппу, заключена в комплексном характере взаимодействия объекта исследования (пробы), электродной системы и электрического поля. Любой из электрохимических методов может быть использован как для прямых измерений, основанных на получении зависимости аналитического сигнала от состава (свойств) вещества пробы, так и для индикации конечной точки титрования (косвенные методы). Электрохимические методы можно разделить на методы измерения:
– пассивных электрических параметров биожидкости;
– активных электрических параметров биожидкости;
– электромиграционные методы.
Общей их характеристикой являются:
– высокая информативность;
– способность получать информацию о биообъекте и форме электрического сигнала;
– широкий спектр возможностей исследования биопробы.
Сложность электрохимических методов – комплексный характер взаимодействия биообъекта с поддерживающей средой, электродной средой и электрическим полем.
Измерение пассивных параметров (сопротивление, проницаемость) определяется исследованием импеданса двухэлектродной измерительной ячейки, которая носит активно-емкостный характер. В качестве воздействующего поля используется переменное электрическое поле, и исследуются активная и реактивная составляющие импеданса биопробы.
В пассивных электрохимических методах измеряют электропроводность проб (кондуктометрия), диэлектрическую проницаемость (диэлектрометрия), импеданс (абсорбционная импедансометрия).
Измерение активных параметров основано на исследовании следующих физико-химических явлений биожидкости:
– электролиз;
– поляризация;
– образование двойных электронных слоев;
– измерение метафазных потенциалов.
Измерение активных параметров реализуется в методах:
– полярографии;
– амперолибрическом нитровании;
– кулонометрии;
– концентрациометрии;
– потенциометрии.
Достоинства методов – высокая чувствительность, простота аппаратурного обеспечения, возможность проведения исследования на естественной биопробе при минимальной пробоподготовке.
Кондуктометрия обладает чувствительностью около 1% изменения концентрации, определяет концентрацию вещества до 10-6 моль/л. Проводимость биопробы является интегральным параметром, зависящим от многих факторов: вязкости среды, температуры и количества компонент. При переменном составе биопробы проводимость не может быть связана напрямую с концентрацией одного какого-либо компонента биопробы. Этот метод дает только общую характеристику солевого обмена и общую концентрацию электролитов.
Кондуктометрические анализаторы могут быть использованы для высокочастотного бесконтактного титрования, в этом случае можно получить количественный анализ концентрации вещества в биопробе без ее предварительной обработки.
Полярография и кулонометрия – электрохимические методы анализа сложных биологических объектов. Позволяют проводить прямой анализ, чувствительность методов 10-5 моль/л.
Методы ограничиваются исследованием веществ в биопробе, способных окисляться или восстанавливаться электрохимическим путем на электродах. На результат измерения влияет наличие белковых и других фонов в растворе, что приводит к изменению силы тока электролита и дает большую погрешность в количественном определении анализируемых веществ. Предназначены для измерения неорганических веществ в растворах. Для анализа необходимо малое количество биопробы (0,1 мл).
Потенциометрический метод считается идеальным в плане минимальности внутренних превращений в пробе в процессе анализа. Это единственный метод, который не использует внешнее энергетическое воздействие и не расходует при измерении внутренней энергии биологического объекта.
Сущность метода: измеряется потенциал измерительного электрода относительно потенциала опорного электрода, помещенного в биожидкость. Этот метод может быть использован для измерения кислотности любых растворов, как правило, на основе использования индикаторных или водородных электродов, а в качестве источника опорного потенциала используют неполяризующийся хлорсеребряный электрод.
В последние годы использование мембранных ионно-селективных электродов расширило использование этого метода для определения многих анионов и катионов веществ.
Биопроба может быть проанализирована в ее естественном состоянии с сохранением всех ее свойств и свойств ее компонентов. Сам процесс измерения потенциалов электродов предусматривает создание условий, исключающих потребление тока в измеряемой цепи, что обеспечивает отсутствие процесса рассеивания энергии в биопробе.
Измерительные электроды – диаметр до 3 мм. Объем пробы 0,2-0,3 мл. Метод ограничен анализом минерального состава биопробы, низкой чувствительностью при прямых измерениях. Метод негоден для измерения биохимических компонентов.
3. Миграционные методы, в которых до начала измерения параметров многокомпонентной пробы присутствует обязательный этап предварительного расселения вещества на отдельные компоненты. Этот этап может осуществляться различными способами.
В электромиграционных методах (электрофорез) для разделения вещества используются процессы миграции заряженных частиц в жидкой среде во внешних электрических полях. Электрофоретический анализ позволяет проводить идентификацию и определение концентрации различных макромолекул, микрочастиц, клеток по их подвижности в направлении силовых линий электрического поля. Он играет важную роль в исследованиях белков и их компонентов, нуклеиновых кислот, пептидов, аминокислот и т. п., поскольку, используя незначительные количества исследуемого вещества, дает возможность проводить очень тонкое фракционирование. Метод позволяет быстро решить вопрос о качественном и количественном составе исследуемой пробы, а также проверить чистоту белковых препаратов, выделенных любыми другими методами. Кроме электрофореза используется диализ – разделение высоко- и низкомолекулярных компонентов на полупроницаемых мембранах вследствие избыточного давления (осмоса) или ионного обмена. Явление диализа осуществляется при приложении внешнего постоянного электрического поля, ускоряющего процесс.
В основе метода хроматографии лежат процессы неравномерного распределения (разделения) компонентов смеси между веществами неподвижной (стационарной) и подвижной фаз, обусловленные различным сродством компонентов пробы к этим фазам. В зависимости от строения, разделяемые компоненты пробы в различной степени удерживаются той или другой фазами и будут отделены друг от друга.
4. Методы, основанные на взаимодействии вещества пробы с различными излучениями. Здесь также можно выделить:
- оптические методы;
- методы, основанные на эффектах ядерной физики.
Широкое распространение оптических методов исследования объясняется тем, что на их основе создаются как сложные приборы для тончайшего анализа биологических веществ, так и простые, компактные и дешевые приборы, позволяющие измерять целый ряд важных показателей, характеризующих свойства или концентрацию отдельных компонентов сложных субстратов и жидкостей. Оптические методы измерения основаны нафизико-химических явлениях, возникающих при взаимодействии излучения оптического диапазона с веществом: уменьшении интенсивности, изменении фазы, пространственной ориентации, спектрального состава излучений и т. п. В сложных полидисперсных гетерогенных средах эти изменения для разных компонентов различны, что позволяет судить об их наличии и концентрации путем регистрации световых потоков, прошедших исследуемую пробу, отраженных от нее, либо излучаемых веществом пробы. При использовании специальных методов освещения исследуемых сред, находящихся в жидкой фазе или в виде высушенных "отпечатков" на стеклянных или пленочных подложках, можно восстановить пространственное распределение дисперсных фаз, а также оценить параметры отдельных фрагментов, твердых включений, пузырьков газа, клеток, микроорганизмов и др.
Оптические методы исследования биожидкости можно разделить по виду регистрируемой энергии, несущей информацию о биообъекте [8]:
– интегрально или избирательно поглощенной энергии;
– рассеянной энергии биожидкостью;
– исследование вторичного излучения возбужденной биожидкостью;
– исследование показателей преломления, отражения и дифракции света;
– спектральные методы;
– другие и двойные физические эффекты в биожидкости.
Методы, основанные на исследовании взаимодействия излучения оптического диапазона с веществом:
– абсорбционная фотометрия;
– абсорбционная спектрометрия;
– фотоколориметрия;
– нефелометрия;
– турбидиметрия.
Фотоколориметрия – исследование окрашенного различными химическими веществами раствора биожидкости, вступившими во взаимодействие с атомами и молекулами исследуемого вещества с образованием ярко окрашенного раствора. Окраска раствора определяет состав и структуру молекул растворенного вещества, а также зависит от энергии связи внутри молекул. Минимальное количество вещества, определяемое фотометром составляет 10-7 моль/метр (10-5%). Недостатки: необходимость сложной подготовки, что приводит иногда к нарушению ее тонкой структуры. Необходимо выдержать оптическую плотность биопробы от 0,01 до 0,02. Окраска иногда является мерой концентрации, как и оптическая плотность, следовательно, необходимо очищать раствор биопробы от коллоидных и других взвешенных частиц.
Нефелометрия – исследование рассеяния света биожидкостью по всевозможным направлениям.
В лабораторных исследованиях большую группу составляют методы спектрального анализа, в которых для изучения состава пробы и определения концентраций компонентов используются оптические спектры излучения и поглощения вещества. Спектральные методы обычно связаны с полным разрушением биообъекта, поэтому их применение ограничивается оценкой минерального состава биопроб, анализа натрия, калия и кальция в сыворотке крови, быстро и точно определяются минимальные концентрации (кальций» 10-5%, калий, магний» 10-6%). Спектрофотометрические методы позволяют определить более 50-ти элементов за исследование.
В группу спектральных методов анализа входят:
– атомно-эмиссионный метод;
– метод пламенной фотометрии;
– метод атомно-абсорбционный;
– атомно-флуоресцентный анализ.
Наиболее распространена из атомно-эмиссионных методов пламенная фотометрия, суть которой заключается в том, что соли металлов, попадая в пламя горелки, способны окрашивать его, так как при повышении температуры молекулы распадаются на отдельные ионы, переходят из одного квантового состояния в другое, что сопровождается излучением света. Температура зависит от природы элемента и не зависит от состава биопробы. Сложностью в пламенной фотометрии является создание высокотемпературного пламени для анализа элементов с высокой энергией перехода электронов.
Атомная абсорбциометрия изучает обратный процесс –поглощение света с определенной длиной волны при переходе электронов на более высший уровень, характерный для исследуемых атомов. Разность диапазона поглощаемой волны измеряется долями нанометра, поэтому для измерений необходимо создавать высоколинейные источники света – специальные лампы, в баллонах которых находятся разогретые пары того же элемента, концентрацию которого определяют.
Достоинство – высокая избирательность, недостаток – необходимо иметь набор ламп для всех видов элементов, используемых в анализе.
Атомно-флуоресцентный анализ (флюорометрия) – определение количества вещества в люминесцентном анализаторе. Основан на измерении относительной величины возбужденного с помощью внешнего УФ излучения свечения. Обладает высокой чувствительностью 10-10г вещества. Флюорометрия может быть использована для измерения концентрации аминокислот, плазмы, белков, витаминов, продуктов обмена. Метод позволяет проводить измерение в клетке, в препарате биоткани. В практике используется для определения адреналина и витаминов группы В. Недостатком люминесцентных анализаторов является невозможность определять концентрации веществ в области их больших концентраций, так как наблюдается эффект тушения люминесценции. Интенсивность люминесценции зависит от кислотности среды, а воздействие УФ на биопробу разрушает ее структуру. Достоинство – высокая избирательность, отсутствие необходимости предварительной пробоподготовки.
Данные методы отличаются необходимостью предварительного перевода исследуемой пробы в атомарное состояние.
Методы лабораторного анализа, основанные наэффектах ядерных взаимодействий, включают ряд методов, позволяющих изучать тонкую структуру многокомпонентных проб. Они основаны на взаимодействиях вещества с различного рода проникающими излучениями, эффекты которых проявляются на молекулярном и атомарном уровнях. Эти методы получили достаточно ограниченное распространение в лабораторной практике в связи со сложностью методического и технического обеспечения и необходимостью соблюдения мер защиты обслуживающего персонала от проникающих излучений. Однако ядерные методы интенсивно развиваются, совершенствуются и становятся все более доступными, чему способствует появление новых медико-биологических и экологических задач, при решении которых подобные методы оказываются наиболее эффективными.
Ядерные методы используют различные эффекты, проявляющиеся при взаимодействия излучений с веществом:
– явление радиоактивности, т. е. способности атомных ядер самопроизвольно или искусственно распадаться;
– излучение корпускулярного или электромагнитного потоков, формируемых под действием ряда физических факторов;
– явление ионизации вещества (масс-спектрометрия), которое используется для регистрации распределения ионных пучков в пространстве и во времени; при этом пакеты ионов формируются из молекул исследуемого вещества и разделяются а зависимости от отношения массы иона к его заряду;
– явления резонансов, наблюдаемые под действием переменных по частоте электромагнитных и магнитных полей; при этом регистрируются характерные спектры, отражающие состав вещества или зависящие от концентрации некоторых компонентов (спектроскопия магнитного резонанса);
– явление взаимодействия вещества с потоком электронов, лежащее в основе методов электронной микроскопии;
– взаимодействие вещества с рентгеновским излучением;
– рентгеноспектральный анализ, регистрируется спектр обратного рентгеновского излучения, который несет широкую информацию о межатомном расстоянии в кристаллических решетках вещества, что позволяет судить о структуре биопробы;
– рентгеноструктурный анализ позволяет исследовать структуру входящих в биожидкость соединений, а также наличие отдельных компонент по дифракционной картине рассеяния рентгеновского излучения на кристаллических решетках вещества и неоднородностях.
Заключение
Рассмотрев существующие на настоящее время методы и средства для исследования состава и структуры вещества, можно сделать следующие заключения:
– чувствительность современных методов лабораторного анализа, реализуемых на отечественной лабораторной технике (анализаторах) примерно одинакова и слабо зависит от метода анализа, кроме специальных методов;
– специальные анализаторы и анализаторы узкого назначения имеют чувствительность на два порядка выше, чем универсальные, кроме этого они требуют меньше подготовки;
– этап пробоподготовки обязателен для всех видов анализаторов, хотя сложность, длительность и стоимость его могут быть различны;
– не один анализатор не может выполнить все виды химических и биохимических анализов.
В настоящее время широко развивается новое аналитическое направление, использующее микробиологические и биологические селективные измерительные преобразователи для анализаторов. Сейчас существуют форменные электроды для измерения азотных соединений в биожидкости, позволяющие определить двухвалентные ионы азота, ферментные смеси различных биологических веществ. Второй тип биологических измерительных преобразователей – микробиологические, с помощью которых можно исследовать витамины, белки, антибиотики, однако они пока не нашли широкого применения из-за большого времени проведении измерений.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Ахутина В.М. Биотехнические системы: теория и проектирование. – Л.: Изд-во ЛГУ, 1981. – 287 с.
2. Попечителев Е.П. Инженерные аспекты медико-биологических исследований. – Л.: ЛЭТИ, 1982. – 234 с.
3. Попечителев Е.П. Физические и физико-химические методы исследования биожидкостей. – Л.: ЛЭТИ, 1988. – 208 с.
4. Фарзане Н.Г., Илясов Л.В., Азим-Заде А.Ю. Технологические измерения и проборы. – М.: ВШ, 1989. – 295 с.
5. Попечителев Е.П. Методы медико-биологических исследований. – Л.: ЛЭТИ, 1979. – 346 с.
6. Лабораторные методы исследования в клинике/ Под ред. В.В. Меньшикова. – М.: Медицина, 1987. – 368 с.
7. Столяров Е.А., Орлова Н.Г. Расчет физико-химических свойств жидкостей / Справочник. – Л.: Химия, 1976. – 278 с.
8. Попечителев Е.П., Старцева О.Н. Аналитические исследования в медицине, биологии и экологии: Учебное пособие. – СПб.: СПбГЭТУ(ЛЭТИ), 1999. – 80 с.
9. Усиков С.В. Электрометрия жидкостей. – Л.: Химия, 1974. – 341 с.
10. Худякова Т.А., Крешков А.П. Теория и практика кондуктометрического и хронокондуктометрического анализа. – М.: Химия, 1976. – 357 с.
11. Герасимов Б.И. Проектирование аналитических приборов для контроля состава и свойств веществ. – М.: Машиностроение, 1984. – 427 с.
12. Гюнтер Х. Введение в курс спектроскопии ЯМР. – М.: Мир, 1982. – 295 с.
Содержание
ВВЕДЕНИЕ…………………………………………………………3
1. ОСНОВЫ КЛИНИЧЕСКОГО АНАЛИЗА
БИОЖИДКОСТИ………………………………………….……….4
1.1. Задачи медицинской лабораторной службы…………………4
1.2. Структура и функция биотехнических систем
лабораторного анализа…………………………………….……….5
2. БИОТЕХНИЧЕСКИЕ СИСТЕМЫ
ЛАБОРАТОРНОГО АНАЛИЗА…………………………………..7
2.1. Связь между основными звеньями…………………………...7
2.2. Средства отбора проб…………………………………………8
2.3. Средства пробоподготовки…………………………………...9
2.4. Анализ биопробы……………………………………….……10
2.5. Биожидкости как объекты исследования…………….……..12
3. МЕТОДИЧЕСКИЕ И ИЗМЕРИТЕЛЬНЫЕ ЭФФЕКТЫ
АНАЛИТИЧЕСКИХ ИССЛЕДОВАНИЙ……………………….15
3.1. Методические схемы проведения исследований…………..15
3.2. Измерительные эффекты для аналитических
исследований………………………………………………………17
3.3. Метрологическое обеспечение аналитических
исследований……………………………………………………....23
4. УНИФИКАЦИЯ И НАДЕЖНОСТЬ МЕТОДОВ АНАЛИТИЧЕСКИХ ИССЛЕДОВАНИЙ………………………..29
4.1. Унификация и стандартизация методов анализа……...……29
4.2. Оценка надежности аналитических методов
исследования………………………………………………………32
5. АНАЛИТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОЖИДКОСТИ………………………………………………….32
5.1. Общая характеристика аналитических методов……………32
5.2. Выбор метода и средств для лабораторного анализа………33
5.3. Методы и средства активного воздействия на биопробу….35
5.4. Основные характеристики аналитических методов………..37
5.5. Классификация методов аналитических исследований……39
Заключение…………………………………..…………………….51
БИБЛИОГРАФИЧЕСКИЙ СПИСОК……………………….…...52
Содержание………………………..………………………………53
Приложение………………………………………………………..54
Приложение
КЛАССИФИКАТОР
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 201; Нарушение авторских прав?; Мы поможем в написании вашей работы!