
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Измерение электрической проводимости
|
|
|
|
Таким образом, сопоставляя молярные (эквивалентные) проводимости электролита при бесконечном разбавлении и при концентрации с можно определить степень и константу диссоциации слабого электролита.
Электрохимия
3.1.1. Свойства растворов электролитов
Электролиты - это вещества, молекулы которых полностью или частично распадаются на ионы при растворении или в расплаве. Доля молекул электролита, распавшихся на ионы, называется степенью диссоциации данного электролита a:
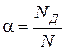 , (3.1)
, (3.1)
где NД – число продиссоциировавших молекул, N – общее число молекул электролита.
В зависимости от величины степени диссоциации электролиты принято делить на сильные (полностью распадаются на ионы, a=1) и слабые (диссоциируют незначительно, 0<a<<1).
Степень диссоциации слабого электролита связана с константой диссоциации законом разбавления Оствальда
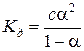 , (3.2)
, (3.2)
из которого следует, что степень диссоциации увеличивается при уменьшении концентрации и, в пределе, при бесконечном разбавлении, a=1 для любого электролита.
Вследствие сильных электростатических взаимодействий между ионами, термодинамические свойства растворов электролитов значительно отличаются от свойств неэлектролитных систем. Так, понижение температуры замерзания, повышение температуры кипения при образовании растворов, а также осмотическое давление всегда больше, чем соответствующие величины, предсказанные законами разбавленных растворов. Поскольку данные параметры относятся к коллигативным свойствам растворов, т. е. зависящим от числа частиц растворенного вещества, Вант-Гоффом предложено использовать поправку, учитывающую увеличение числа частиц в растворе за счет диссоциации, которая получила название изотонического коэффициента i. Например, осмотическое давление в разбавленном растворе электролита может быть найдено по уравнению
|
|
|
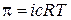 (3.3)
(3.3)
где с – моляльная концентрация
Изотонический коэффициент электролита, молекула которого распадается на k ионов, можно легко рассчитать:
i = a(k -1)+1 (3.4)
В случае сильных электролитов уже при небольших концентрациях раствора наблюдаются значительные отклонения от идеальности, поэтому вместо концентрации в термодинамических уравнениях следует использовать активность a. Так как в растворах сильные электролиты присутствуют только в виде ионов, следует говорить об активности катионов a+ и активности анионов a- . В то же время, поскольку в растворе всегда присутствуют как катионы, так и анионы, определить эти величины невозможно и на практике используют средние ионные активности a±, которые можно найти экспериментальным путем. Наряду со средними ионными активностями, используют также средние ионные концентрации c± и коэффициенты активности γ±:
a± = c± × γ± (3.5)
Средние ионные величины являются средними геометрическими из соответствующих параметров катиона и аниона. Для сильного электролита, диссоциирующего на катион K+ и анион A- по схеме
M = n+K+ + n-A-
средние ионные величины находят по уравнениям
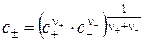 (3.6)
(3.6)
 (3.7)
(3.7)
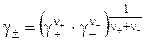 (3.8)
(3.8)
Средний коэффициент активности электролита является мерой отклонения раствора от идеальности за счет межионных электростатических взаимодействий. В бесконечно разбавленных растворах из-за бесконечного расстояния между ионами такие взаимодействия отсутствуют и γ± обращается в единицу, в этом случае активность становится равной концентрации. С ростом концентрации в разбавленных растворах γ± как правило уменьшается. Интенсивность электростатического поля в растворе, зависящая от концентрации всех ионов, находящихся в растворе, и их зарядов, характеризуется параметром ионной силы I:
|
|
|
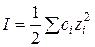 (3.9)
(3.9)
где ci и zi – концентрация и заряд i-го иона.
Так как ионы взаимодействуют посредством электростатического поля, ионная сила раствора и коэффициент активности электролита должны быть взаимосвязаны. Льюисом экспериментальным путем установлено правило ионной силы: средний коэффициент активности электролита определяется только ионной силой раствора и не зависит от того, какими электролитами она создается. Количественная взаимосвязь γ± и I дается теорией сильных электролитов Дебая-Хюккеля в виде уравнения первого приближения Дебая, именуемого также предельным законом Дебая:
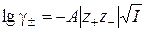 (3.10)
(3.10)
где A – коэффициент, зависящий от природы растворителя и температуры (для водных растворов при 298К А=0,509)
Уравнение соблюдается до ионных сил порядка 0,01 моль/л, для расчетов при больших ионных силах в него вводят различные полуэмпирические поправки.
3.1.2. Электрическая проводимость растворов электролитов
Электрической проводимостью называют величину, обратную сопротивлению проводника:
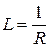 (3.11)
(3.11)
Известно, что сопротивление зависит от длины проводника l и площади его поперечного сечения S по уравнению
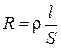 (3.12)
(3.12)
где r - удельное сопротивление.
Поэтому
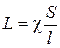 (3.13)
(3.13)
Величина c, обратная удельному сопротивлению, называется удельной электрической проводимостью. Она выражается в Ом-1×м-1 или См×м-1 (См – «сименс», величина, обратная ому) Такой электрической проводимостью обладает раствор электролита, в который погружены два параллельных электрода площадью 1 м2 каждый, расположенные на расстоянии 1 м друг от друга. Удельная электрическая проводимость электролита связана с концентрацией ионов в растворе, а также со скоростями их движения:
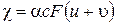 (3.14)
(3.14)
 где F – число Фарадея (F=96485 Кл/моль), u и u - абсолютные скорости движения катиона и аниона соответственно.
где F – число Фарадея (F=96485 Кл/моль), u и u - абсолютные скорости движения катиона и аниона соответственно.
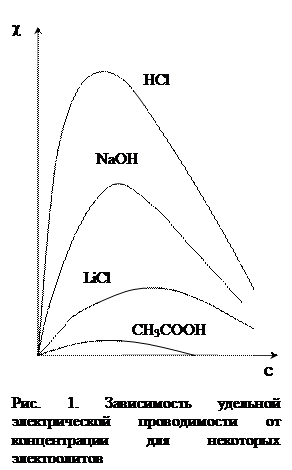
Так как скорости u и u также зависят от концентрации электролита, концентрационная зависимость удельной электрической проводимости имеет сложный характер и проходит через максимум, она представлена на рис. 1.
Для практических целей наиболее часто используют также молярную или эквивалентную электрическую проводимости l, которые относятся к раствору, содержащему соответственно 1 моль или 1 эквивалент растворенного электролита и помещенному между электродами, находящимися на расстоянии 1 м друг от друга. Из определения молярной проводимости следует, что она может быть рассчитана как отношение удельной электрической проводимости к концентрации электролита
|
|
|
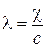 (3.15)
(3.15)
и имеет размерность См×м2×моль-1. Сопоставив уравнения (3.14) и (3.15) получим
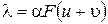 (3.16)
(3.16)
При бесконечном разбавлении раствора молярная электрическая проводимость, в отличие от удельной, не обращается в нуль и приобретает определенное для каждого электролита значение l¥:
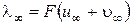 (3.17)
(3.17)
Произведения Fu¥ и Fu¥ для каждого иона постоянны и называются предельными подвижностями катиона и аниона соответственно. По аналогии с проводимостью электролита в целом их обозначают как 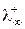 и
и 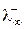 . Таким образом, при бесконечном разбавлении молярная электрическая проводимость электролита складывается из двух постоянных величин, характеризующих свойства катиона и аниона (закон независимого движения ионов Кольрауша):
. Таким образом, при бесконечном разбавлении молярная электрическая проводимость электролита складывается из двух постоянных величин, характеризующих свойства катиона и аниона (закон независимого движения ионов Кольрауша):
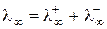 (3.18)
(3.18)
В растворах слабых электролитов из-за малой степени диссоциации концентрация ионов очень мала, поэтому скорости движения ионов практически не отличаются от предельных величин u¥ и u¥, следовательно, разделив (3.16) на (3.17), получим
 (3.19)
(3.19)
Подставляя данное выражение в (3.2) получим еще одну форму закона разбавления Оствальда:
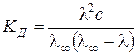 (3.20)
(3.20)
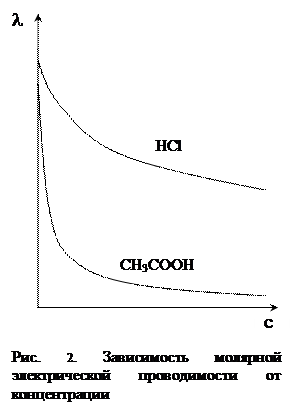 Концентрационные зависимости молярной электрической проводимости представлены на рисунке 2. Снижение l с ростом концентрации в случае слабых электролитов связано с подавлением их диссоциации, а в случае сильных – с проявлением межионных взаимодействий. В разбавленных растворах сильных электролитов выполняется эмпирическое уравнение Кольрауша, устанавливающее линейную зависимость l от с:
Концентрационные зависимости молярной электрической проводимости представлены на рисунке 2. Снижение l с ростом концентрации в случае слабых электролитов связано с подавлением их диссоциации, а в случае сильных – с проявлением межионных взаимодействий. В разбавленных растворах сильных электролитов выполняется эмпирическое уравнение Кольрауша, устанавливающее линейную зависимость l от с:
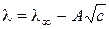 (3.21)
(3.21)
где А – константа, зависящая от электролита и растворителя.
Экстраполяция линейной зависимости в координатах l - 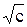 на нулевую концентрацию позволяет экспериментально определять величины l¥ сильных электролитов.
на нулевую концентрацию позволяет экспериментально определять величины l¥ сильных электролитов.
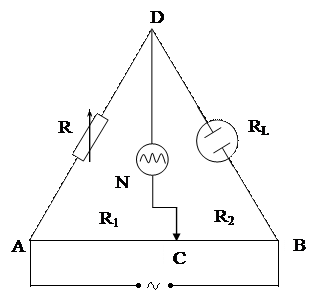 Метод исследования и анализа, основанный на измерении электрической проводимости растворов электролитов, называется кондуктометрией. В кондуктометрии измеряют сопротивление электролита RL, находящегося в ячейке. Кондуктометрическая ячейка представляет собой стеклянный сосуд с вмонтированными в него электродами из индифферентного материала, чаще всего платины или графита (в некоторых случаях может использоваться также высококачественная нержавеющая сталь). Для увеличения площади поверхности платиновых электродов с целью повышения чувствительности (при работе с малыми концентрациями электролитов) а также для уменьшения влияния поляризации их дополнительно платинируют, покрывая мелкодисперсным порошком платины – платиновой чернью. Работа ведется только с переменным током достаточно высокой частоты (обычно 1000 Гц и более). Это обусловлено тем, что при прохождении через раствор постоянного тока
Метод исследования и анализа, основанный на измерении электрической проводимости растворов электролитов, называется кондуктометрией. В кондуктометрии измеряют сопротивление электролита RL, находящегося в ячейке. Кондуктометрическая ячейка представляет собой стеклянный сосуд с вмонтированными в него электродами из индифферентного материала, чаще всего платины или графита (в некоторых случаях может использоваться также высококачественная нержавеющая сталь). Для увеличения площади поверхности платиновых электродов с целью повышения чувствительности (при работе с малыми концентрациями электролитов) а также для уменьшения влияния поляризации их дополнительно платинируют, покрывая мелкодисперсным порошком платины – платиновой чернью. Работа ведется только с переменным током достаточно высокой частоты (обычно 1000 Гц и более). Это обусловлено тем, что при прохождении через раствор постоянного тока  происходит электролиз, продукты которого покрывают электроды, повышая сопротивление ячейки. Для измерения сопротивления применяется мостовая схема (мостик Кольрауша), изображенная на рисунке 3. Источник переменного тока с выходным напряжением в несколько вольт замыкают на постоянное сопротивление реохорда АВ, выполненного в виде однородной проволоки из константана или манганина, натянутой на линейку длиной 100 см. По закону Кирхгофа из точки А мостика ток идет по ветвям АСВ и ADB. Перемещая подвижной контакт реохорда С можно найти такое его положение, при котором потенциалы точек D и С равны (при равенстве падений напряжения на участках AD и AC и, как следствие, на участках DB и CB) и ток на участке DC не идет.
происходит электролиз, продукты которого покрывают электроды, повышая сопротивление ячейки. Для измерения сопротивления применяется мостовая схема (мостик Кольрауша), изображенная на рисунке 3. Источник переменного тока с выходным напряжением в несколько вольт замыкают на постоянное сопротивление реохорда АВ, выполненного в виде однородной проволоки из константана или манганина, натянутой на линейку длиной 100 см. По закону Кирхгофа из точки А мостика ток идет по ветвям АСВ и ADB. Перемещая подвижной контакт реохорда С можно найти такое его положение, при котором потенциалы точек D и С равны (при равенстве падений напряжения на участках AD и AC и, как следствие, на участках DB и CB) и ток на участке DC не идет.
|
|
|
Если сила тока в ветви ADB I1, а в ветви ACB I2, то, выразив падение напряжения на участках цепи через произведение силы тока на соответствующее сопротивление, получим
I1RM = I2R1 и I1RL = I2R2
где RM –выбранное сопротивление магазина сопротивлений.
Отсюда, разделив первое уравнение на второе, получим
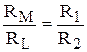 ,
, 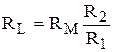 .
.
или
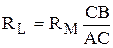 , (3.22)
, (3.22)
где СВ и АС – длины правого и левого плеч реохорда соответственно.
В качестве нуль-инструмента N, предназначенного для индикации отсутствия или наличия тока, в диагональ моста вводится осциллограф или низкоомный телефон. Положение контакта С выбирают таким, при котором сила тока оказывается наименьшей. Это соответствует минимальной амплитуде сигнала на экране осциллографа или наименьшей силе звука в телефоне.
Если бы расстояние между электродами в ячейке равнялось точно 1 м, площадь поверхности каждого электрода составляла 1 м2 и в проведении тока участвовал только тот объем раствора, который заключен между электродами, то измеренная в данных условиях электрическая проводимость по определению представляла бы собой удельную электрическую проводимость раствора. В действительности электрическая проводимость раствора зависит не только от размеров электродов и расстояния между ними, но и от формы электродов, их взаимного расположения и объема раствора, так как ток проводит весь раствор, а не только объем, заключенный между электродами. Поэтому удельная электрическая проводимость c не равна измеренной электрической проводимости раствора, а лишь пропорциональна ей:
c = K/R (3.23)
Коэффициент пропорциональности К (м-1) называют константой сосуда. Абсолютная величина константы зависит от размеров и формы сосуда, в котором производится измерение электрической проводимости.
Для определения константы сосуда измеряют сопротивление раствора стандартного электролита (обычно KCl), с известной удельной электрической проводимостью при данной концентрации:
K = cстRст, (3.24)
где Rст – измеренное сопротивление стандартного раствора, справочное значение удельной электрической проводимости которого cст.
В настоящее время серийно выпускаются портативные автоматические приборы – кондуктометры, реализующие указанный принцип измерения на современной элементной базе и позволяющие экспрессно определять сопротивление и электрическую проводимость в широком диапазоне значений.
3.1.3. Равновесные электродные процессы
При погружении металла в раствор электролита возможно протекание двух противоположно направленных процессов – выхода катионов металла из кристаллической решетки в раствор под действием полярных молекул растворителя S и перехода катионов из раствора на поверхность металлической фазы:
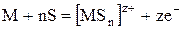 (3.25)
(3.25)
Преобладание прямого или обратного процесса связано с соотношением затрачиваемой энергии выхода катиона из металла Uвых и выделяющейся энергии сольватации катиона Uсольв. Если Uсольв > Uвых, реакция (3.25) идет слева направо до установления равновесия, а высвобождающиеся электроны придают металлу отрицательный заряд. Если Uсольв < Uвых, энергетически выгодной становится обратная реакция, в результате которой металл заряжается положительно. Таким, образом, на металлическом электроде осуществляется обратимый окислительно-восстановительный процесс, называемый электродной реакцией, в результате которого при достижении равновесия возникает некоторый электрический потенциал, получивший название электродного потенциала j.
Абсолютную величину электродного потенциала измерить невозможно, поэтому в настоящее время используется относительная шкала, в основе которой потенциал водородного электрода, принятый за нуль в стандартных условиях (P=1 атм, 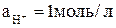 ). Применение такого подхода позволяет рассчитывать электродные потенциалы по следующей формуле:
). Применение такого подхода позволяет рассчитывать электродные потенциалы по следующей формуле:
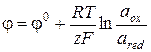 , (3.26)
, (3.26)
или, при использовании десятичного логарифма,
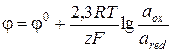 (3.27)
(3.27)
где aox и ared – активности окисленной и восстановленной форм окислительно-восстановительной системы, формирующей электродную реакцию; j0 – стандартный электродный потенциал, равный электродному потенциалу при единичных активностях реагентов (величины j0 являются справочными данными).
Необходимо помнить, что если в электродной реакции участвует несколько реагентов, активности каждого из них должны фигурировать в уравнении (3.27), при этом в числителе и знаменателе записываются произведения активностей веществ, составляющих соответственно окисленную и восстановленную формы, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Электроды различных типов
В зависимости от устройства и электродных реакций различают следующие типы электродов.
1. Электроды первого рода. Представляют собой металл, погруженный в раствор его соли, т. е. раствор, содержащий ионы этого металла. Например, медная пластинка, опущенная в раствор сульфата меди.
Устройство электрода принято выражать схемой, на которой слева от вертикальной черты, изображающей границу раздела фаз, пишут символы ионов раствора, а справа – вещества электрода. Для медного электрода схема запишется в виде
Cu2+ïCu
В общем случае схема электрода первого рода имеет следующий вид:
Mz+ïM
Электродной реакцией является обратимый процесс
Mz+ + ze- = M
В соответствии с уравнением (3.27) потенциал электрода первого рода определяется по формуле
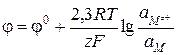 (3.28)
(3.28)
Так как активность чистого металла aM всегда равна 1, уравнение (3.28) упрощается:
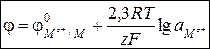 (3.29)
(3.29)
Потенциал электрода первого рода зависит только от активности катиона металла, поэтому говорят, что электрод обратим по отношению к катиону.
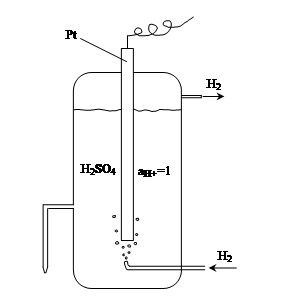
К электродам первого рода принято также относить газовые электроды. Они состоят из инертного металла, находящегося в одновременном контакте с газом и с раствором, содержащим ионы этого газа. Наиболее распространенным из таких электродов является водородный электрод, представляющий собой платиновую пластинку, омываемую током газообразного водорода, погруженную в раствор, содержащий ионы водорода (рис. 4):
H+ïH2, Pt
Платина в таком электроде играет роль носителя газообразного водорода и токоотвода, а электродная реакция аналогична процессу на металлическом электроде
2H+ + 2e- = H2
 Потенциал такого электрода, с учетом того, что активность газа можно заменить на его давление, выраженное в атмосферах, рассчитывается следующим образом
Потенциал такого электрода, с учетом того, что активность газа можно заменить на его давление, выраженное в атмосферах, рассчитывается следующим образом
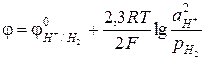 (3.30)
(3.30)
Поскольку стандартный потенциал водородного электрода принят равным нулю при любой температуре (условие использования водородной шкалы потенциалов), получим
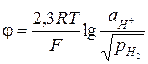 (3.31)
(3.31)
При атмосферном давлении

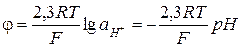 (3.32)
(3.32)
Таким образом, потенциал водородного электрода является линейной функцией показателя активности протонов в растворе.
Водородный электрод находит широкое применение в электрохимии. Его используют в качестве электрода сравнения при измерении электродных потенциалов, а также для определения рН различных сред. К недостаткам водородного электрода относят необходимость работы с газообразным водородом и высокие требования к чистоте используемых реактивов и материалов – при наличии примесей поверхность платины легко отравляется, что приводит к изменению потенциала водородного электрода и, соответственно, к искажению результатов измерений.
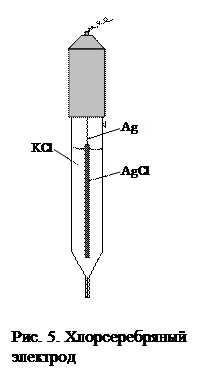
2. Электроды второго рода. Представляют собой металл, покрытый слоем м мего малорастворимой соли и погруженный в раствор, содержащий анион этой соли. Схема такого электрода записывается следующим образом:
Az-½MA, M
В электродной реакции принимают участие все три реагента, при этом в качестве окисленной формы выступает малорастворимая соль МА:
MA + ze- = M + Az-
Применяя к данной реакции уравнение (3.27), получим выражение для потенциала электрода второго рода:
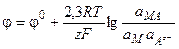 (3.33)
(3.33)
 Учитывая равенство единице активностей твердых веществ, можно показать, что потенциал электрода второго рода определяется активностью анионов в растворе:
Учитывая равенство единице активностей твердых веществ, можно показать, что потенциал электрода второго рода определяется активностью анионов в растворе:
 (3.34)
(3.34)
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 69; Нарушение авторских прав?; Мы поможем в написании вашей работы!