
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Напівавтоматичний прилад для визначення температури плавлення.
|
|
|
|
4. Контрольні питання
73. Що таке калібрувальний графік?
74. Що таке інструментальне титрування.
75. Що таке метод добавок?
76. Що таке ареометр?
77. В яких одиницях вимірюється густина розчинів?
Лекція 9: Рефрактометрія, поляриметрія.
Мета: Засвоїти основи рефрактометрії та поляриметрії.
План:
1. Рефрактометрія
2. Поляриметрія.
1. Рефрактометрія
Рефрактометрія – це визначення показника заломлення. Показник заломлення (n) є однією з констант, що добре характеризують індивідуальність та ступінь чистоти органічної сполуки. 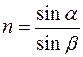
Визначається спеціальним приладом – рефрактометром, який працює на принципі вимірювання граничного кута заломлення. Якщо кут падіння 90° (саме цей кут використовується в рефрактометрах), то промінь світла утворює граничний кут заломлення. При цьому 
Вимірюючи b і знаючи n1 можна визначити n2 Граничний кут визначають по границі світла й тіні що спостерігається в рефрактометрах. Середовищами є скло (скляні призми) з відомим показником заломлення та середовище показник заломлення якого визначаємо.
 |
Показник заломлення  залежить від:
залежить від:
ü Природи речовини
ü Густини
ü Концентрації розчину
ü Температури
ü Тиску
ü Довжини хвилі.
Перед початком вимірювань прилад перевіряють по дистильованій воді. 
Індекс D означає що використовують жовту лінію в спектрі натрієвої лампи.
Верхній індекс показує температуру при якій визначають показник заломлення.
Для ідентифікації речовини показник заломлення можна визначити з точністю 3 знаки після коми, для перевірки чистоти 4 знаки після коми.
Як правило будують калібрувальний графік залежності показника заломлення від концентрації розчину по розчинах з відомою концентрацією.
|
|
|
 |
Далі визначивши показник заломлення невідомого розчину визначають його концентрацію.
Інколи використовують рефрактометричний фактор F, який показує збільшення показника заломлення розчину при зростанні його концентрації на 1%.

Знаючи показник заломлення розчину та розчинника можна визначити його концентрацію.
2. Поляриметрія.
Базується на вимірюванні обертання площини поляризації плоскополяризованого світла оптично активними речовинами. Це як правило речовини що мають асиметричний атом карбону (атом карбону пов’язаний з 4 різними замісниками). Використовується плоскополяризоване світло яке поляризується при проходженні через призму Ніколя, яка складається з двох призм ісландського шпату.
Питоме обертання- це обертання площини поляризації в градусах a при проходженні світла через 1% розчин товщина кювети 1 дм. (+) за годинниковою стрілкою, (-) проти годинникової стрілки.
(+) за годинниковою стрілкою, (-) проти годинникової стрілки.
Використовують прилади – поляриметри.
Концентрацію розраховують за формулою: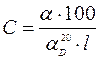
Питоме обертання площини поляризації залежить від природи речовини, довжини хвилі поляризованого світла, температури. Із збільшенням довжини хвилі поляризованого світла питоме обертання площини поляризації зменшується, а з підвищенням температури зростає. Як правило питоме обертання площини поляризації проводять при 20°С і жовтої лінії натрію.
3. Контрольні питання
89. Рефрактометрія.
90. Поляриметрія.
Лекція 10: Атомно-емісійний спектральний аналіз.
Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
План:
1. Основні принципи атомно-емісійного спектрального аналізу.
2. Принципова схема роботи полуменевого фотометра.
3. Практичне застосування методу.
4. Контрольні питання
1. Основні принципи атомно-емісійного спектрального аналізу.
|
|
|
Метод являє собою визначення наявності та концентрацій тих чи інших хімічних елементів за спектром випромінювання атомів цих хімічних елементів.
Для отримання спектру випромінювання хімічних елементів речовина що аналізується нагрівається до високих температур. Під дією високих температур атоми збуджуються і електрони з основного переходять на вищі енергетичні рівні. Але на вищих енергетичних рівнях електрони перебувають недовго тривало і знову переходять на основні енергетичні рівні випромінюючи при цьому енергію певних частот. Сукупність частот на яких відбувається випромінювання атомів того чи іншого хімічного називається спектром випромінювання цього хімічного елемента.
Вивчаючи спектр який випромінює речовина що аналізується та знаючи спектри випромінювання хімічних елементів можна провести якісний аналіз проб, тобто встановити атоми яких хімічних елементів присутні в пробі.
Більш широко використовується кількісний атомно-емісійний аналіз. Інтенсивність спектральних ліній випромінювання хімічних елементів залежить від кількості атомів цих елементів тобто від їх концентрації і вимірюючи інтенсивність випромінювання можна визначити концентрацію. Зв'язок між інтенсивністю та концентрацією виражається формулою Б.А. Ломакіна.
I = a C b
Де I – інтенсивність спектральної лінії
a, b – сталі величини
Як правило вимірюють інтенсивність випромінювання не всіх спектральних ліній того чи іншого хімічного елемента, а лише однієї найбільш інтенсивної лінії в спектрі яка при цьому не перекривається з лініями випромінювання атомів інших хімічних елементів. Для відокремлення випромінювання саме потрібної частоти використовують інтерференційні світлофільтри або монохроматор.
Для створення високої температури як правило використовують полум’я газового пальника хоча інколи використовують електричну дугу, електричну іскру або плазмотрон.
Наприклад для визначення концентрацій натрію, калію кальцію та літію вимірюють випромінювання атомів цих хімічних елементів на таких довжинах хвиль:
| Хімічний елемент | Довжина хвилі, нм |
| Натрій (Na) | |
| Калій (K) | |
| Кальцій (Ca) | |
| Літій (Li) |
Всього цим методом можна визначити концентрації приблизно 60 хімічних елементів що входять до складу тих чи інших сумішей.
|
|
|
Цей метод дуже широко використовується на практиці, тому в світі випускається різними фірмами багато приладів наприклад полуменевий фотометр Jenway PFP7.

2. Принципова схема роботи полуменевого фотометра.
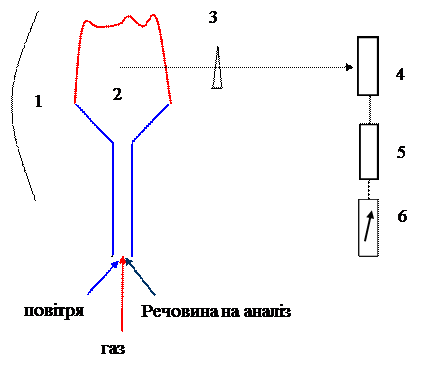 |
1. Дзеркало.
2. Полум’я пальника.
3. Інтерференційний світлофільтр або монохроматор.
4. Фотоелемент.
5. Фото підсилювач.
6. Мікроамперметр.
Для створення високої температури використовуємо полум’я газового пальника. В залежності від потрібної температури (вона залежить від того який хімічний елемент потрібно визначити) використовуємо для створення полум’я різні суміші:
| Суміш | Температура полум’я °С |
| Повітря – пропан | |
| Повітря – ацетилен | |
| Закис азоту – ацетилен | |
| Повітря – водень | |
| Закис азоту – водень | |
| Кисень – ацетилен | |
| Закис азоту - пропан |
В полум’я з постійною швидкістю подається розчин що аналізується. В полум’ї під дією високої температури відбувається випромінювання світла атомами хімічних елементів. Дзеркало допомагає спрямувати це випромінювання на фотоелемент. За допомогою світлофільтра або монохроматора відокремлюємо лише ту довжину хвилі у спектрі яка нам потрібна. Стум від фотоелемента після підсилювача реєструється мікро амперметром.
Найбільш широко користуються методом добавок. Спочатку вимірюють струм який створюється за рахунок наявності атомів визначаємого хімічного елементу, потім в зразок додатково вводять певну точно відому концентрацію того ж хімічного елементу (добавку) і знову визначають струм. Розрахунок концентрації проводять за формулою:
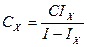
Де CX – концентрація атомів визначає мого елементу в пробі
C – концентрація за рахунок добавки
IX - струм без наявності добавки
I - струм при наявності добавки.
Для підвищення точності вимірюють інтенсивність струму з двома добавками з різними концентраціями і розрахунки тех. Проводять двічі. Результати при цьому повинні співпадати.
|
|
|
Інколи застосовують метод попереднього побудови калібрувального графіку. Але умови в яких відбувається побудова калібрувального графіка та умови в яких відбувається аналіз проб повинні бути абсолютно однаковими.
3. Практичне застосування методу.
Метод полуменевої фотометрії є арбітражним методом визначення іонів металів у харчовій промисловості. Наприклад іонів лужних та лужно-земельних металів у воді, соках інших напоях та інших харчових продуктах. При цьому ці продукти (наприклад сир) спочатку переводять у рідкий стан.
4. Контрольні питання
80. На чому базується атомно-емісійний спектральний аналіз?
81. Що таке спектр випромінювання атома хімічного елементу?
82. Яким чином створюється висока температура?
83. Яку функцію виконує світлофільтр або монохроматор?
84. Що таке метод добавок?
85. Застосування методу у харчовій промисловості.
Лекція 11: Атомно-абсорбційний аналіз.
Мета: Засвоїти принципи атомно-абсорбційного аналізу.
План:
1. Основні принципи атомно-абсорбційного спектрального аналізу.
2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
3. Практичне застосування методу.
4. Контрольні питання
1. Основні принципи атомно-абсорбційного спектрального аналізу.
Метод являє собою визначення наявності та концентрацій тих чи інших хімічних елементів за поглинанням при високих температурах атомами цих хімічних елементів квантів світла з певними довжинами хвиль.
Метод багато в чому нагадує атомно-емісійний спектральний аналіз. Але він ґрунтується на вимірюванні не випромінювання, а поглинання світла атомами хімічних елементів.
Речовина що аналізується нагрівається до високих температур.
Для створення високої температури як правило використовують полум’я газового пальника.
Джерело випромінювання лампа з порожнистим катодом, яка дає випромінювання саме тих довжин хвиль, які поглинають атоми хімічного елемента що аналізується. При цьому для кожного хімічного елемента використовується своє джерело випромінювання (вони входять в комплект поставки приладу) що містить саме цей елемент що аналізується. Наприклад для аналізу на Купрум – лампа що містить саме Купрум та випромінює кванти світла з довжиною хвилі 324,7 нм, для аналізу на Плюмбум лампа що містить Плюмбум та випромінює кванти світла з довжиною хвилі 283,3 нм і так далі. Ці лампи досить коштовні. Існують лампами з кількома хімічними елементами, спектри яких не перекриваються.
Інтенсивність поглинання світла прямо пропорційна концентрації хімічного елемента. Але на чутливість визначення впливає також фон, адже може відбуватись не тільки поглинання квантів світла атомами визначає мого хімічного елемента, а також їх випромінювання. Для усунення впливу цього явища реєструючий прилад синхронізують з модулятором, який з певною частотою перериває світловий потік від лампи і враховує та вилучає постійний сигнал від фонового випромінювання.
Межа визначення деяких елементів сягає 10-11 10-12 грама тому метод широко використовують для аналізу мікро кількостей та домішок.
Тривалість та трудомісткість аналізу порівняно невелика, не потрібно попередньо проводити відокремлення одних хімічних елементів від інших. Хоча прилади досить дорогі та персонал лабораторії повинен мати відповідну кваліфікацію.
Всього цим методом можна визначити концентрації приблизно 70 хімічних елементів що входять до складу тих чи інших сумішей.
Цей метод дуже широко використовується на практиці, тому в світі випускається різними фірмами багато приладів наприклад квант-2А

2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
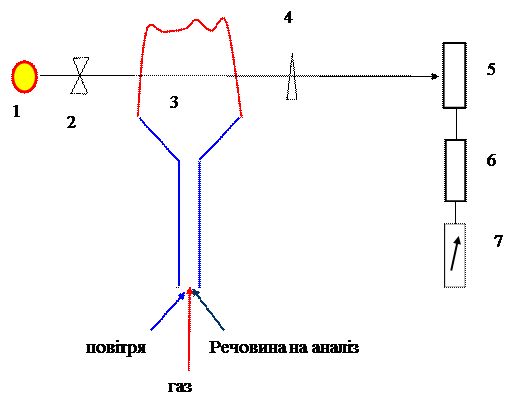 |
7. Джерело випромінювання лампа з порожнистим катодом що містить той же хімічний елемент який визначаємо.
8. Модулятор
9. Полум’я пальника.
10. Монохроматор.
11. Фотоелемент.
12. Фото підсилювач.
13. Мікроамперметр.
Для створення високої температури використовуємо полум’я газового пальника. В залежності від потрібної температури (вона залежить від того який хімічний елемент потрібно визначити) використовуємо для створення полум’я різні суміші:
| Суміш | Температура полум’я °С |
| Повітря – пропан | |
| Повітря – ацетилен | |
| Закис азоту – ацетилен | |
| Повітря – водень | |
| Закис азоту – водень | |
| Кисень – ацетилен | |
| Закис азоту - пропан |
В полум’я з постійною швидкістю подається розчин що аналізується. В полум’ї відбувається поглинання квантів світла від лампи атомами хімічного елементу що визначається. За допомогою монохроматора відокремлюємо лише ту довжину хвилі у спектрі яка нам потрібна. Стум від фотоелемента після підсилювача реєструється мікро амперметром. Модулятор дозволяє врахувати та відокремити фонове випромінювання.
Найбільш широко користуються методом добавок. Спочатку вимірюють струм який створюється за рахунок наявності атомів визначаємого хімічного елементу, потім в зразок додатково вводять певну точно відому концентрацію того ж хімічного елементу (добавку) і знову визначають струм. Розрахунок концентрації проводять за формулою:
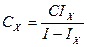
Де CX – концентрація атомів визначає мого елементу в пробі
C – концентрація за рахунок добавки
IX - струм без наявності добавки
I - струм при наявності добавки.
Для підвищення точності вимірюють інтенсивність струму з двома добавками з різними концентраціями і розрахунки тех. Проводять двічі. Результати при цьому повинні співпадати.
Застосовують також метод попереднього побудови калібрувального графіку. Але умови в яких відбувається побудова калібрувального графіка та умови в яких відбувається аналіз проб повинні бути абсолютно однаковими.
3. Практичне застосування методу.
Атомно-абсорбційний метод аналізу широко використовується в харчовій промисловості для визначення мікро кількостей токсичних важких металів. Наприклад для визначення Купруму, Плюмбуму, Хрому, Нікелю, Кадмію, Цинку, Марганцю в воді, напоях, молоці, мясі, рибі та в інших харчових продуктах.
Тверді продукти попередньо оброблюють та переводять присутні в них хімічні елементи в розчин. Як правило проводять спалювання проб при поступовому підвищенні температури до 450°С і обробки золи розбавленою нітратною кислотою.
4. Контрольні питання
86. На чому базується атомно-абсорбційний метод аналізу?
87. Які джерела світла використовуються в цьому методі.
88. Яку функцію виконує модулятор?
89. Яку функцію виконує світлофільтр або монохроматор?
90. Застосування методу у харчовій промисловості.
Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції.
Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
План:
3. Основи методу
4. Фотометричне титрування
5. Застосування для аналізу харчових продуктів
6. Контрольні питання
4. Основи методу
Базуються на вимірюванні поглинання світла речовиною.
В залежності від довжини хвилі розрізняють методи що використовують видиме світло (l= 400 – 800 нм.), ультрафіолетове (l= 10 – 400 нм), інфрачервоне (l = 800 нм – 1000 мкм).
Найбільш широко використовується видимий діапазон спектру. При цьому речовина має забарвлення.
Інколи використовується для аналізу речовин які не поглинають світло, але які можна перевести в інші речовини що поглинають світло.
При проходженні світла відбувається його поглинання:
 |
I0 – промінь що падає
I1 – промінь що відбився від повехні скло-повітря
I2 – промінь що розсіявся
I3 – промінь що відбився від поверхні скло-розчин
I4 – промінь, що поглинувся речовиною
I -промінь, що вийшов
Користуючись однаковими кюветами фактори I1 I2 I3 можна врахувати, тоді: I0 = I4 + I.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1189; Нарушение авторских прав?; Мы поможем в написании вашей работы!