
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Явище люмінесценції
10. Контрольні питання
95. На чому базується метод турбидіметрії та нефелометрії.
96. На чому базується метод флуориметрії.
97. Що таке люмінесценція?
98. Яку джерело випромінювання використовують в люмінесцентному аналізі?
Лекція 14: Потенціометрія та потенціометричне титрування.
Мета: Засвоїти основи потенціометрії.
План:
10.Основи потенціометрії.
11.Потенціометричне титрування.
12.Контрольні питання.
11. Основи методу
Потенціометрія ґрунтується на вимірювання потенціалу індикаторного електроду який пов'язаний з концентрацією рівнянням Нернста:
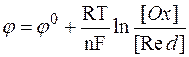
Де 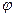 - потенціал електрода,
- потенціал електрода,
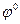 - потенціал електрода в стандартних умовах,
- потенціал електрода в стандартних умовах,
R – універсальна газова стала,
T – температура по шкалі Кельвіна,
n – число електронів з електронного балансу,
F – число Фарадея,
[Ox] – концентрація окисленої форми,
[Red] – концентрація відновленої форми.
Так як не існує методів вимірювання абсолютного значення потенціалу, а лише різниці потенціалів, то для вимірювання необхідний також ще один електрод – електрод порівняння потенціал якого сталий.
Аналіз зводиться до того що два електроди (індикаторний та порівняння) занурюють в розчин що аналізується. При цьому фактично виникає гальванічний елемент та вимірюють ЕРС (електрорушійну силу) цього гальванічного елементу.
Розроблена велика кількість індикаторних іон селективних електродів для визначення різних катіонів та аніонів. Наприклад можна вимірювати H+, Na+, K+, Cu2+, NO3-, Cl- …
Установка для аналізу складається з електродів індикаторного та порівняння (інколи ці електроди виконують в одному корпусі) та вимірювального блоку.
Для деяких систем вимірювальний блок градуюють не в мілівольтах, а відразу в одиницях концентрації.
Наприклад в рН метрії. Використовують прилади рН метри які градуюють в одиницях рН. Індикаторний скляний електрод.
рН = - lg [H+].
Електрод порівняння це як правило хлор срібний електрод. Дротик з срібла вкритий тонким шаром нерозчинного хлориду срібла і занурений у розчин хлориду калію. Потенціал цього електроду в насиченому розчині калій хлориду 0,222, а в 1М розчині калій хлориду 0,237 вольта.


|
Дата добавления: 2014-01-04; Просмотров: 269; Нарушение авторских прав?; Мы поможем в написании вашей работы!