
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Амінокислоти
|
|
|
|
Функції білків.
1) Каталітична. Переважна більшість хімічних реакцій в організмі каталізується більш-менш специфічними біологічними каталізаторами – ферментами. Ферменти знижують енергію активації хімічних реакцій в мільйони разів, ефективно прискорюючи їх перебіг. Всі ферменти мають білкову природу. Мабуть, це основна функція білків.
2) Гормональна. Залози внутрішньої секреції продукують у кров в дуже низьких кількостях регуляторні молекули - гормони. Деякі з них мають білкову природу або є похідними амінокислот (інсулін – гормон підшлункової залози, адреналін – наднирників, тиреотропін – щитовидної залози, окситоцин - гіпофіза і т.д.). Гормони регулюють роботу ферментів, процеси транскрипції і трансляції білків.
3) Транспортна. Це забезпечення органів і тканин необхідними речовинами, зокрема поживними. Ліпіди та жиророзчинні вітаміни транспортуються кров’ю у складі ліпопротеїдних комплексів. О2 та СО2 – складним білком гемоглобіном (у м’язах міоглобіном). Багато лікарських препаратів зв’язується альбуміном крові.
4) Захисна. У разі попадання до організму антигену (мікроорганізми, токсини) спеціальні імунокомпетентні клітини (відносяться до лейкоцитів) виробляють продукти білкового походження – антитіла. Антитіла знешкоджують антигени і служать маркерами для подальшого фагоцитозу. Вони відносяться до класу білків – глобулінів.
5) Енергетична. 10-15% енергії організм отримує з білків, 1 г білку відповідає 17,7 кДж.
6) Механічна. Білки забезпечують механічний рух організмів. У м’язах тварин присутні актин, міозин, тропоніни, які забезпечують м’язеве скорочення.
7) Структурна. В середньому білки складають 45-50% сухої маси тварин (м’зи – 80, печінка – 57, кістки – 28). Вони виступають структурною основою клітин і, відповідно, тканин і органів.
|
|
|
Амінокислоти – похідні органічних кислот аліфатичного або ароматичного ряду і містять аміно- та карбоксильну групи (звідки походить й назва). Загальна формула:
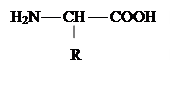 |
Вони відрізняються між собою природою радикала (R). До складу більшості білків входять 20 амінокислот, 10 з яких найбільш розповсюджені.
Класифікація амінокислот: аліфатичні (моноаміномонокарбонові, моноамінодикарбонові, діаміномонокарбонові, діамінодикарбонові) та циклічні (ароматичні, гетероциклічні):
1) моноаміномонокарбонові:
гліцин аланін cерин треонін
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N — CH — COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N — CH — COOH
½ ½ ½ ½
H CH3 CH2 — OH CH ¾ OH
½
 CH3
CH3
валін лейцин ізолейцин цистеїн
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
½ ½ ½ ½
CH ¾ СH3 CH2 CH ¾ СH3 CH2 ¾ SH
½ ½ ½
CH3 CH2 ¾ СH3 CH2 ¾ СH3
½
 CH3
CH3
метіонін
 H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH
½
CH2
½
CH2 ¾ S ¾ CH3
2) моноамінодикарбонові:
аспарагінова кислота (аспартат) глутамінова кислотата (глутамат)
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
½ ½
CH2 (CH2)2
½ ½
COOH COOH
3) діаміномонокарбонові:
лізин аргінін
 H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOH
½ ½
(CH2)4 (CH2)3
½ ½
NH2 HN
 ½
½
С = NH
½
NH2
4) діамінодикарбонові:
цистин
 H2N ¾ CH ¾ COOH NH2
H2N ¾ CH ¾ COOH NH2
½ ½
CH2 ¾ S ¾ S ¾ CH2 ¾ CH
½
COOH
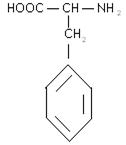
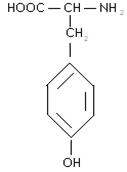
5) ароматичні:
фенілаланін тирозин
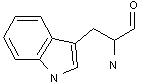
6) гетероциклічні:
триптофан гістидин пролін оксипролін
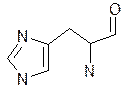
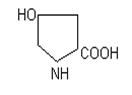
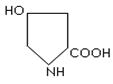
Фізико-хімічні властивості. Це безбарвні кристалічні речовини, які добре розчиняються у воді, різні на смак; tплавлення>200 оС, деякі при нагріванні розкладаються (фенілаланін, тирозин, цистеїн і інш.). Всі містять аміногрупу біля a-вуглецевого атому, тому є a-амінокислотами. Можливість оптичної ізомерії є наслідком наявності 4 різних замісників біля вуглецевого атому:
|
|
|
R1
½
R4 ¾ C ¾ R2
½
R3
Амінокислоти є оптично-активними сполуками, це проявляється у тому, що вони обертають кут плоскополяризованого світла вліво або вправо. В залежності від просторової конфігурації замісників біля a-вуглецевого атому вони поділяються на Д та L-ізомери. Це стереоізомерія, для якої є „ключ” – гліцериновий альдегід:
COH COH
½ ½
H ¾ C* ¾ OH ОН ¾ C* ¾ H
½ ½
CH2OH CH2OH
D-ізомер L-ізомер
У відповідності до цього:
СOOH СOOH
½ ½
H ¾ C ¾ NH2 H2N ¾ C ¾ H
½ ½
R (D-амінокислота) R (L-амінокислота)
В білках рослинного і тваринного походження переважають амінокислоти L-ряду.
Амінокислоти – амфотерні сполуки, які містять 2 функціональні групи: карбоксильну і амінну. Згідно хімічної теорії: кислоти – донори Н+, луги – акцептори Н+. Тому у водних розчинах амінокислот утворюється нейтральна сполука – внутрішня сіль амінокислоти (це стосується моноаміномонокарбонових кислот), внаслідок внутрішньомолекулярної взаємодії:
H2N ¾ CH ¾ COOH H3N+ ¾ CH ¾ COO-
½ «½
R R (цвіттеріон = біполярний іон)
В водних розчинах амінокислоти виявляють властивості амфотерних електролітів (амфолітів):
H3N+ ¾ CH ¾ COO- H3N+ ¾ CH ¾ COOH
½ + H+ «½
R R
H3N+ ¾ CH ¾ COO- H2N ¾ CH ¾ COO-
½ + OH- «½ + Н2О
R R
Значення рН середовища, при якому сумарний заряд амінокислоти становить „0” – ізоелектрична точка. В цій точці кислота електронейтральна і не рухається в електричному полі. Вона залежить від кількості груп здатних до іонізації. Слід зазначити, що ступінь іонізації карбоксильних груп дещо вище, ніж аміногруп, тому для моноаміномокарбонових кислот ізоелектрична точка спостерігається при рН близьких до 5-6.
Окремі хімічні реакції, методи визначення і розділення. Амінокислоти здатні реагувати по обом функціональним групам, а також мають і специфічні властивості:
- взаємодія аміногрупи з азотистою кислотою (на цій реакції грунтується метод кількісного визначення амінокислот по Д.Ван-Сляйку):
R ¾ CH ¾ COOH R ¾ CH ¾ COOH
½ + HNO2 ® ½ + N2 + H2O
H2N OH (оксикислота)
- реакція аміногрупи з формальдегідом (лежить в основі методу формольного титрування або кількісного визначення амінокислот по С.П.Сьоренсену):
|
|
|
HOOC ¾ CH ¾ NH2 HOOC ¾ CH ¾ N = CH2
½ + HCOH ® ½ + H2O
R R (метиленове похідне)
- взаємодія зі спиртами з утворенням складних ефірів (використовується для розділення і визначення амінокислот шляхом фракційної перегонки їх ефірів в вакуумі):
H2N ¾ CH ¾ COOH H2N ¾ CH ¾ COOC2H5
½ + С2H5 OH ® ½ + H2O
R R (складний ефір)
- реакція з нінгідрином; при нагріванні a-амінокислот з нінгідрином вони зазнають окисного дезамінування і декарбоксилювання, а нінгідрин відновлюється і формує димери, внаслідок чого утворюється сполука синьо-фіолетового кольору (рН>5), відповідний амінокислоті альдегід та СО2; кольор утворюваних сполук залежить від рН та природи амінокислоти, в присутності органічних розчинників утворюються сполуки, які мають червоний, жовтий, голубий кольор тощо (реакція використовується для лабораторного визначення амінокислот та в автоматичних аналізаторах).
Велике значення в багатьох галузях харчової промисловості має взаємодія амінокислот з відновлюючими цукрами (їх карбонільною групою). При цьому розкладається як амінокислота, так і цукор. З амінокислоти утворюється відповідний альдегід, аміак і СО2, а з цукру – фурфурол або оксиметилфурфурол:
H2N ¾ CH ¾ COOH CH3 ¾ CH ¾ CH2 ¾ COH
½ + цукор (ксилоза) ® ½ + NH3 + CO2 + фурфурол
СH2 CH3
½ (ізовалеріановий альдегід)
CH ¾ CH3
½
CH3
Альдегіди мають специфічний запах, від якого великою мірою залежить аромат харчових продуктів. Фурфурол (оксиметилфурфурол) утворює з амінокислотами темнозабарвлені продукти – меланоїдини. Ці процеси відбуваються при зберіганні, сушці плодів і овочів, термічній обробці м’яса, виготовленні кондитерських виробів.
Добування та розділення. Амінокислоти добувають гідролізом білків (лужний, кислотний, ферментативний), хімічним синтезом та мікробіологічними методами. Зокрема, внаслідок кислотного гідролізу утворюється суміш амінокислот, які можна розділити кількома методами:
|
|
|
Хроматографічним (іонообмінна хроматографія на смолах, тонкошарова на папері і інш.). В основі методу розділення лежать кислотно-основні властивості амінокислот (заряд) та їх сорбційна здатність. Наприклад, при тонкошаровій хроматографії амінокислоти в залежності від їх заряду і сорбційної здатності з різною швидкістю рухаються разом з розчинником по хроматографічному паперу від лінії старту.
Електрофорез. В основі методу також лежать кислотно-основні властивості амінокислот (заряд при різному значенні рН). При електрофорезі на папері наносять на змочений буфером фільтрувальний папер пляму суміші амінокислот, розділення відбувається у постійному електричному струмі з високою напругою. Амінокислоти, які при даному рН електронейтральні, залишаються на своєму місці, інші, в залежності від заряду, мігрують до катоду/аноду.
В сучасній промисловості для добування окремих амінокислот широко застосовують мікробіологічний метод. Наприклад, лізин добувають, використовуючі штами Micrococcus, як поживне середовище використовують малясу, кукурудзяний екстракт, білкові гідролізати, як джерело азоту – солі амонію і сечовину. Триптофан добувають за участю мутантів E.coli.
Незамінні амінокислоти. В організмі не синтезуються, обов’язково повинні до нього надходити з їжею. Це 8 амінокислот: валін, лейцин, ізолейцин, треонін, метіонін, лізин, фенілаланін, триптофан. Напівзамінні амінокислоти утворюються в недостатній кількості, а замінні повністю синтезуються з інших сполук. Метіонін, лізин і триптофан входить до складу кормових концентратів, які підвищують якість відгодівлі сільськогосподарських тварин. Вони поліпшують засвоєння білку, збільшують нагромадження азоту, стимулюють ріст і розвиток молодих тварин. Метіонін використовують при захворюваннях печінки, недокрів’ї, опіках. Триптофан – для лікування пелагри, психічних хвороб.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1869; Нарушение авторских прав?; Мы поможем в написании вашей работы!