
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II.1. Аминотрансферазы
|
|
|
|
В метаболизме азотсодержащих соединений важную роль играют реакции переноса аминогрупп с остатков аминокислот на другие соединения (например, кетогруппы). Это реакции трансаминирования. Они катализируются ферментами, коферментом для которых служит пиридоксальфосфат (производная пиридоксина – витамина B6).

Пиридоксальфосфат ковалентно связан с ферментом за счёт взаимодействия альдегидной группы пиридоксальфосфата и аминогруппы аминокислоты лизина, входящей в состав белковой молекулы фермента (альдиминная связь).
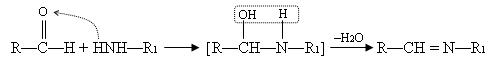
Кроме этой связи пиридоксальфосфат связывается с белковой частью фермента за счёт ионных связей с участком фосфорного остатка и за счёт заряженного атома азота в пиридиновом кольце.

Соединение лизина и пиридоксальфосфата имеет плоское строение, обусловленное пиридиновым кольцом и дополнительной водородной связью между атомом N и атомом H гидроксильной группы.
В процессе реакции трансаминирования аминокислоты, конкурируя с лизином, способны разрывать связь остатка лизина с карбонильной группой передоксальфосфата, вытесняя его из комплекса с ферментом.
Кофермент в этом случае играет роль посредника, т.е. промежуточного акцептора аминогруппы. Весть процесс переноса аминогруппы (NH2) с α-аминокислоты на α-кетокислоту происходит в несколько стадий:
1) На первой аминогруппа субстрата (например, аланина), конкурируя с лизином, образует альдиминную связь с передоксальфосфатом.
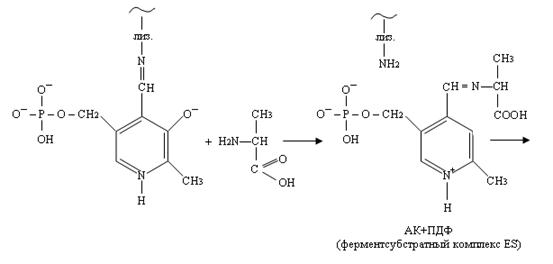
2) Внутримолекулярная перестройка. Под влиянием изомеразы двойная связь переходит от одного углерода к другому.
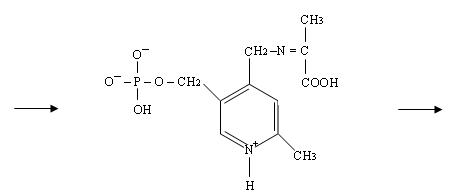
Образуется кетоиминная группировка – промежуточное соединение, у которого двойная связь находится у того атома углерода, который будет связан с кислородом на следующей стадии.
|
|
|
3) Стадия гидролиза. При этом образуется аминогруппа на коферменте и кетогруппа на бывшей аминокислоте.
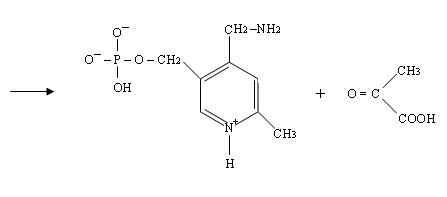
4) Четвёртая стадия происходит при наличии второго субстрата, которым является кетокислота, например, 2-оксоглутаровая:
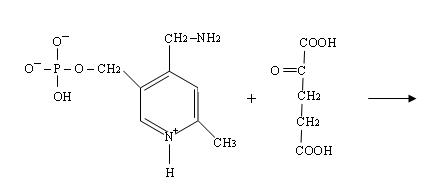
При этом происходит переход пиридоксальфосфата в исходную альдегидную группировку с лизином
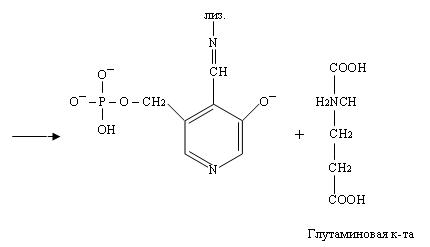
Как видно из уравнений, механизм реакции такой же, как при взаимодействии пиридина с аминокислотой, только конкурентами за кетогруппу кислоты становятся лизин и пиридоксальфосфат.
Осуществление рассмотренной последовательности реакций становится возможным благодаря возникающим конкурентным отношениям. По конкурирующим способностям за карбонильной группой пиридоксальфосфата аминокислоты располагаются в следующий ряд:
глутамат < остаток лизина в полипептиде < остаток аминокислоты
Суммарно весь этот процесс можно изобразить следующим образом:
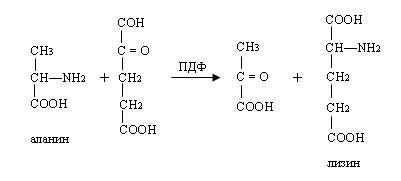
ПДФ в комплексе с декарбоксилазой может катализировать декарбоксилированные глутаминовые кислоты (образуется γ-аминомасляная кислота), гистодина, триптофана и др. аминокислоты.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1207; Нарушение авторских прав?; Мы поможем в написании вашей работы!