
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамический процесс
Изменение состояния системы, характеризующееся изменением ее термодинамических параметров, называется термодинамическим процессом. Иными словами, если система переходит из исходного состояния в конечное, отличное от исходного, то совершается процесс. Чаще всего в термодинамике рассматриваются следующие процессы:
1) изотермический (T = const), {греческое therme – жар, теплота};
2) изобарный (р = const), {греческое baros – тяжесть, вес};
3) изохорный ( (V = const), {греческое chora – пространство};
4) изобарно-изотермический (р = const, Т = const);
5) изохорно-изотермический (V = const, Т = const);
6) адиабатический (отсутствует обмен теплотой между системой и внешней средой).
Процесс, в результате которого система, выйдя из начального состояния и претерпев ряд превращений, вновь в него возвращается, называется круговым процессом или циклом.
Изменение состояния системы может происходить при различных условиях. Поэтому различают в первую очередь равновесные (квазистатические) и неравновесные процессы. Процесс, рассматриваемый как непрерывный ряд равновесных состояний системы. называется равновесным процессом. При равновесном процессе все параметры системы меняются бесконечно медленно, так что система все время находится в состоянии равновесия.
Чтобы термодинамический процесс осуществлялся квазистатически (равновесно), необходимо выполнение следующих условий:
1. Бесконечно малая разность действующих и противодействующих сил (например, давление в системе на бесконечно малую величину отличается от внешнего давления).
2. Бесконечно медленное течение процесса.
3. Совершение максимальной работы (при неравновесном процессе работа всегда меньше, чем при равновесном и может быть равной нулю – например, расширение идеального газа в вакуум).
4. Изменение внешней силы на бесконечно малую величину меняет направление процесса на обратный.
5. Абсолютные значения работ прямого и обратного процессов одинаковы, а их пути совпадают.
Процесс перехода системы из неравновесного состояния в равновесное называется релаксацией, а продолжительность этого процесса – временем релаксации. У различных процессов время релаксации неодинаково: от 10-7 секунды для установления равновесного давления в газе до нескольких лет при выравнивании концентраций в твердых сплавах.
Следует отметить, что реальные процессы протекают при нарушении равновесия между системой и окружающей средой, при этом возникают потоки энергии и или вещества внутри системы, нарушая в ней равновесие. Поэтому реальные процессы, протекающие с нарушением равновесного состояния системы, являются неравновесными. В классической (феноменологической) термодинамике изучаются только равновесные процессы. Выводы, полученные термодинамикой для равновесных процессов, играют в ней роль своего рода предельных теорем.
Физически бесконечно медленным или квазистатическим (равновесным) изменением какого-либо параметра «а» называют такое его изменение со временем, когда скорость изменения da / dt значительно меньше средней скорости изменения этого параметра при релаксации (здесь t – время). Если при релаксации параметр «а» изменился на Δ а, а время релаксации τ, то при равновесных процессах
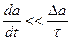
Если изменение параметра «a» происходит за время t, меньшее или равное времени релаксации τ, так что
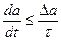
то такой процесс является неравновесным или нестатическим.
Кроме понятий равновесных (квазистатических) и неравновесных процессов в термодинамике все процессы делят на обратимые и необратимые. Обратимый термодинамический процесс – процесс перехода термодинамической системы из одного состояния в другое, который может протекать как в прямом, так и в обратном направлении через те же промежуточные состояния без каких бы то ни было изменений в окружающей среде. Если же процесс перехода системы из одного состояние в другое нельзя осуществить в прямом и обратном направлениях без изменения в окружающей среде, то его называют необратимым процессом. Очевидно, что равновесный процесс всегда обратим, а обратимый процесс всегда протекает равновесным путем.
Примеры необратимых процессов:
1. Процесс теплопередачи при конечной разности температур необратим. Обратимый процесс (как равновесный) начинается с состояния равновесия. Наличие разности температур указывает на неравновесность (нестатичность) процесса.
2. Расширение газа в вакуум необратимo, поскольку при таком расширении не совершается работа, а сжать газ так, чтобы не совершить работы, невозможно.
3. Процесс диффузии газов необратим. Если в сосуде с двумя различными газами, разделенными перегородкой, убрать перегородку, то каждый газ будет диффундировать в другой. Для разделения газов каждый из них нужно сжимать. Чтобы они не нагревались, необходимо отнять у них теплоту и превратить в работу, что невозможно без изменения в окружающей среде (второй закон термодинамики).
|
|
Дата добавления: 2014-01-04; Просмотров: 6466; Нарушение авторских прав?; Мы поможем в написании вашей работы!