
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химической реакции. Уравнение изотермы химической реакции
|
|
|
|
Изобарно-изотермический потенциал (энергия Гиббса)
Итак, если в системе реально (необратимо) протекает реакция типа
 ,
,
то энергия Гиббса системы изменяется, причем согласно (11.5)
 .
.
Для изобарно-изотермической системы изменение энергии Гиббса равно
 . (11.24)
. (11.24)
Проинтегрируем выражение (11.24) для одного пробега реакции (химическая переменная меняется от 0 до 1), считая все μ i = const:
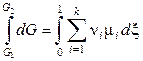 ,
,
 . (11.25)
. (11.25)
В уравнении (11.25) Δr G – изменение энергии Гиббса системы при протекании в ней реакции 1 раз, т. е. при условии, что в реакцию вступило число молей реагирующих веществ, равное стехиометрическим коэффициентам. То, что химические потенциалы компонентов, зависящие от состава, были приняты постоянными, означает, что система содержит достаточно большое количество реагентов (такое, что изменение числа молей реагирующих веществ практически не меняет состава системы).
Если все участники реакции – идеальные газы, то
 , (11.26)
, (11.26)
где  – относительное исходное (неравновесное) парциальное давление i -го газа, т. е. то давление, с которым i -й компонент вступает в реакцию. С учетом выражения (11.26) уравнение (11.25) запишется следующим образом:
– относительное исходное (неравновесное) парциальное давление i -го газа, т. е. то давление, с которым i -й компонент вступает в реакцию. С учетом выражения (11.26) уравнение (11.25) запишется следующим образом:
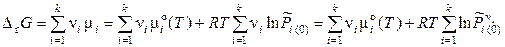 ,
,
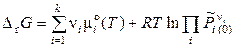 . (11.27)
. (11.27)
Поскольку согласно (11.12)
 ,
,
то
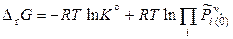 . (11.28)
. (11.28)
Уравнение (11.28) называют уравнением изотермы химической реакции. Для того, чтобы определить, в каком направлении будет протекать реакция, необходимо знать не только константу равновесия, но и состав исходной реакционной смеси. Реакция самопроизвольно будет протекать в прямом направлении (слева направо), если
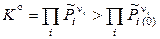 и
и  .
.
Реакция самопроизвольно будет протекать в обратном направлении (справа налево), если
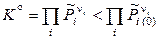 и
и 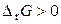 .
.
Для равновесной системы
 и
и 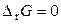 .
.
Если в химическую реакцию вступают компоненты с относительным парциальным давлением, равным единице (т. е. все вещества вступают в реакцию в стандартном состоянии), то уравнение (11.28) принимает вид
|
|
|
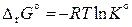 . (11.29)
. (11.29)
Величину Δr G ° называют стандартной энергий Гиббса реакции или стандартным изобарным потенциалом реакции. Очевидно, что Δr G ° определяет направление протекания реакции в стандартных условиях.
Уравнения (11.28) и (11.29) являются фундаментальными уравнениями химической термодинамики, позволяющими определять направление реакции в заданных условиях, рассчитывать константы равновесия реакций (не проводя эксперименты), вычислять выходы продуктов различных реакции и т. п.
Если химическая реакция протекает в изохорно-изотермической системе, то
 , (11.30)
, (11.30)
 , (11.31)
, (11.31)
где
 ,
,  .
.
Стандартную концентрацию С ° обычно принимают равной 1 моль∙л–1. Уравнение (11.30) называют уравнением изотермо-изохоры реакции, а величину Δr A ° – стандартной энергией Гельмгольца (стандартным изохорным потенциалом) реакции.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 748; Нарушение авторских прав?; Мы поможем в написании вашей работы!