
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнения изобары и изохоры Вант-Гоффа
|
|
|
|
Зависимость константы равновесия от температуры.
Качественно зависимость константы равновесия от температуры определяется принципом Ле-Шателье – Брауна. Найдем количественную зависимость константы равновесия от температуры. Стандартная энергия Гиббса реакции равна
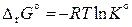 ,
,
поэтому
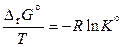 . (11.42)
. (11.42)
После подстановки соотношения (11.42) в уравнение Гиббса – Гельмгольца и преобразований полученного выражения получаем:
 , (11.43)
, (11.43)
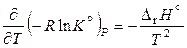 ,
,
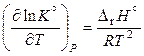 . (11.44)
. (11.44)
Уравнение (11.44), справедливое для реакций, протекающих при постоянном давлении, называют уравнением изобары Вант-Гоффа или уравнением изобары химической реакции Знак производной в уравнении (11.44) определяется знаком теплового эффекта реакции:
если  , то
, то  ,
,
значит, с повышением температуры константа равновесия увеличивается и химическое равновесие смещается в сторону образования продуктов;
если  , то
, то 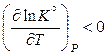 ,
,
следовательно, с ростом температуры константа равновесия уменьшается и равновесие смещается в сторону образования исходных веществ;
если  , то константа равновесия не зависит от температуры.
, то константа равновесия не зависит от температуры.
Зависимость стандартной константы равновесия от температуры при постоянном давлении представлена на рис. 11.1.
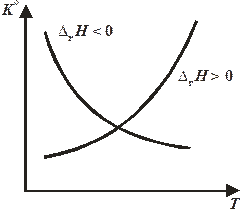
Рис. 11.1. Зависимость константы равновесия от температуры
По аналогии можно получить уравнение
 , (11.45)
, (11.45)
которое называют уравнением изохоры Вант-Гоффа или уравнением изохоры химической реакции (справедливо для реакций, протекающих при постоянном объеме).
Разделим переменные и проинтегрируем уравнение изобары Вант-Гоффа (11.44). Для небольшого интервала температур можно принять, что энтальпия реакция не зависит от температуры, тогда
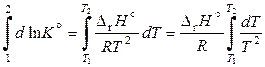 ,
,
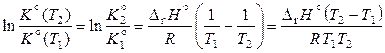 . (11.46)
. (11.46)
По уравнению (11.46) можно определить тепловой эффект реакции на основании двух значений констант равновесия при различных температурах, хотя чаще по этому уравнению определяют константу равновесия при заданной температуре.
|
|
|
При неопределенном интегрировании уравнения (11.44) получаем линейное уравнение
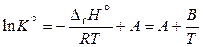 , (11.47)
, (11.47)
где А – константа интегрирования, 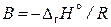 .
.
Линейная зависимость логарифма константы равновесия от обратной температуры (рис. 11. 2) служит подтверждением независимости теплового эффекта реакции от температуры в данном температурном интервале. Таким образом, энтальпия реакции может быть определена по уравнению изобары Вант-Гоффа без калориметрических измерений.

Рис. 11.2. Зависимость ln K° от обратной температуры.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 26940; Нарушение авторских прав?; Мы поможем в написании вашей работы!