
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение адиабаты идеального газа.
|
|
|
|
В любой термодинамической системе (простой или сложной) могут протекать три процесса: изотермический (Т = const), адиабатический (Q = 0) и политропный (С = const, где C – теплоемкость). В простой системе, в которой внешним параметром является объем V, а сопряженной ему обобщенной силой – давление Р, возможны еще два процесса: изохорный (V = const) и изобарный (Р = const). Эти пять процессов (изотермический, адиабатический, политропный, изохорный, изобарный) считаются основными в термодинамике, причем адиабатический процесс является частным случаем политропного.
Уравнения изохорного, изобарного, изотермического процессов для идеального газа получаются из уравнения состояния PV = RT:
РV = const – уравнение изотермы;
Р = аТ, где а = R / V = const – уравнение изохоры;
V = a 1 T, a 1 = R / P = const – уравнение изобары.
Получим уравнение адиабатического расширения (сжатия) идеального газа. Примем, что система совершает только работу расширения и процесс является обратимым (равновесным). Тогда
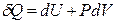
Для идеального газа
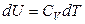 ,
,
следовательно
 .
.
Поскольку процесс адиабатический, то δQ = 0 и, с учетом того, что
 ,
,  ,
,
получаем
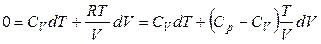 .
.
Разделим левую и правую часть на (СV · Т):
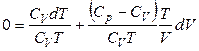 ,
,
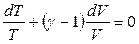 , (2.47)
, (2.47)
где 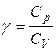 – адиабатический коэффициент (g > 1 для любых систем).
– адиабатический коэффициент (g > 1 для любых систем).
Уравнение (2.47) является дифференциальным уравнением адиабаты в переменных Т и V. Проинтегрировав уравнение (2.47) с учетом того, что теплоемкости СV и Сp (а значит, и адиабатический коэффициент) идеального газа не зависят от температуры и объема, получим:
 ,
,
 ,
,
 (2.48)
(2.48)
Уравнение (2.48) есть уравнение адиабаты идеального газа в переменных Т и V. В переменных P и V уравнение адиабаты принимает вид
 , (2.49)
, (2.49)
так как
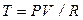 ,
,  .
.
И, наконец, уравнение адиабаты в переменных Р и Т имеет вид
|
|
|
 , (2.50)
, (2.50)
поскольку
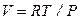 ,
, 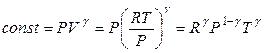 .
.
Уравнения адиабаты (2.48) – (2.50) называются уравнениями Пуассона.
Теплоемкости одноатомных и двухатомных идеальных газов постоянны и равны:
| Идеальный газ | Сp | CV | g |
| одноатомный | 
| 
| 
|
| двухатомный | 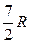
| 
| 
|
Величину γ для реальных газов можно определить, измеряя скорость звука в газе:
 ,
,
где М – молярная масса газа.
Далее, зная величину g, можно, используя в первом приближении уравнение Майера, рассчитать изохорную и изобарную теплоемкость газообразного вещества:
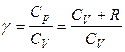 ,
,
 ,
,  ,
, 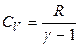 ,
,  .
.
При адиабатическом расширении (сжатии) газа Q = 0 и
 ,
,
то есть положительная работа совершается за счет убыли внутренней энергии. Следовательно, если идеальный газ адиабатически расширяется (W > 0), то D U < 0 и температура газа уменьшается:
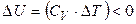 только если
только если  .
.
При адиабатическом сжатии температура газа увеличивается. На практике адиабатическим условиям отвечает быстрое (мгновенное) проведение процессов, когда сравнительно медленно протекающий теплообмен мало влияет на изменение внутренней энергии и температуры. Так, при адиабатическом сжатии газа ударной волной газ не успевает отдать выделившуюся теплоту и сильно нагревается.
Используя уравнения адиабат идеального газа, можно получить несколько уравнений для работы равновесного адиабатического процесса. Так как для адиабатического процесса
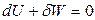
и
 ,
,
то
 .
.
Поэтому работа расширения одного моля идеального газа равна
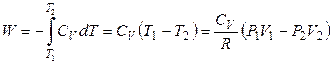 , (2.51)
, (2.51)
а так как 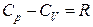 и
и  , то
, то
 . (2.52)
. (2.52)
Следует отметить, что для необратимого адиабатического расширения (сжатия) газа уравнения Пуассона неприменимы. Однако по-прежнему справедливо соотношение
 ,
,
а работа необратимого расширения газа против постоянного внешнего давления равна
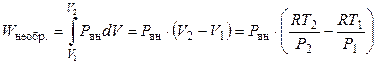 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 9461; Нарушение авторских прав?; Мы поможем в написании вашей работы!