
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики. Энтропия
|
|
|
|
Второй закон термодинамики, как и первый, является постулатом, обоснованным многовековым опытом человечества. Открытию этого закона способствовало изучение тепловых машин. Французский ученый С. Карно первым показал (1824 г.), что любая тепловая машина должна содержать помимо источника теплоты (нагревателя) и рабочего тела (пар, идеальный газ и др.), совершающего термодинамический цикл, также и холодильник, имеющий температуру обязательно более низкую, чем температура нагревателя.
Коэффициент полезного действия η такой тепловой машины, работающей по обратимому циклу (циклу Карно), не зависит от природы рабочего тела, совершающего этот цикл, а определяется только температурами нагревателя Т 1 и холодильника Т 2:
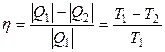 , (3.1)
, (3.1)
где Q 1 – количество теплоты, сообщенное рабочему телу при температуре Т 1 от нагревателя; Q 2 – количество теплоты, отданное рабочим телом при температуре Т 2 холодильнику.
Второй закон термодинамики представляет собой обобщение вывода Карно на произвольные термодинамические процессы, протекающие в природе. Известно несколько формулировок этого закона.
Клаузиус (1850 г.) сформулировал второй закон термодинамики так: невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более горячим.
У. Томсон (Кельвин) (1851 г.) предложил следующую формулировку: невозможно построить периодически действующую машину, вся деятельность которой сводилась бы к совершению механической работы и соответствующему охлаждению резервуара.
Постулат Томсона может быть сформулирован и так: вечный двигатель второго рода невозможен. Вечным двигателем второго рода называют устройство, которое без компенсации полностью превращало бы периодически теплоту какого-либо тела в работу (В.Оствальд). Под компенсацией понимают изменение состояния рабочего тела или отдачу части теплоты рабочим телом другим телам и изменение термодинамического состояния этих тел при круговом процессе превращения теплоты в работу.
|
|
|
Второй закон термодинамики устанавливает, что без компенсации в круговом процессе ни один джоуль теплоты нельзя превратить в работу. Работа же превращается в теплоту полностью без всякой компенсации. Последнее связано, как отмечалось ранее, с самопроизвольностью процесса рассеивания (обесценивания) энергии.
Второй закон термодинамики вводит функцию состояния системы, которая количественно характеризует процесс рассеивания энергии. В этом смысле приведенные формулировки второго закона термодинамики равноценны, ибо из них следует существование функции состояния системы – энтропии.
В настоящее время второй закон термодинамики формулируется следующим образом: существует аддитивная функция состояния системы S – энтропия, которая следующим образом связана с теплотой, поступающей в систему, и температурой системы:
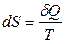 для обратимых процессов; (3.2)
для обратимых процессов; (3.2)
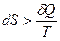 для необратимых процессов. (3.3)
для необратимых процессов. (3.3)
Таким образом, при обратимых процессах в адиабатически изолированной системе ее энтропия не изменяется (dS = 0), а при необратимых процессах увеличивается (dS > 0).
В отличие от внутренней энергии значение энтропии изолированной системы зависит от характера происходящих в ней процессов: в ходе релаксации энтропия изолированной системы должна возрастать, дости гая максимального значения при равновесии.
В общем виде второй закон термодинамики для изолированной системы записывается так:
 . (3.4)
. (3.4)
Энтропия изолированной системы или увеличивается, если в ней протекают самопроизвольные необратимые процессы, или остается постоянной. Поэтому второй закон термодинамики определяют также как закон о неубывании энтропии в изолированных системах.
|
|
|
Таким образом, второй закон термодинамики дает критерий самопроизвольности процессов в изолированной системе. Спонтанно в такой системе могут протекать только процессы, сопровождающиеся увеличением энтропии. Самопроизвольные процессы заканчиваются с установлением равновесия в системе. Значит, в состоянии равновесия энтропия изолированной системы максимальна. В соответствии с этим критерием равновесия в изолированной системе будет
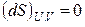 ,
, 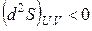 . (3.5)
. (3.5)
Если в процессе принимает участие неизолированная система, то для оценки необратимости (самопроизвольности) процесса необходимо знать изменение энтропии системы dS 1 и изменение энтропии окружающей среды dS 2. Если принять, что система и окружающая среда (их часто называют «вселенной») образуют изолированную систему, то условием необратимости процесса будет
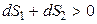 ,
,
то есть процесс будет необратим, если общее изменение энтропии системы и окружающей среды будет больше нуля.
Окружающая среда – огромный резервуар; eе объем и температура не изменяются при теплообмене с системой. Поэтому можно для окружающей среды приравнять δQ = dU и не важно, обратимо или необратимо происходит переход теплоты, так как и δQ обр, и δQ необр точно равны dU окружающей среды. Таким образом, изменение энтропии окружающей среды всегда равно:
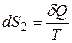 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 4448; Нарушение авторских прав?; Мы поможем в написании вашей работы!