
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коллигативные свойства разбавленных растворов
 |
Зависимость коллигативных свойств разбавленных растворов от концентрации выражается простыми линейными уравнениями. Остановимся на каждом из них подробнее.
1. Понижение давления пара растворителя над раствором. Закон Рауля, которому подчиняется растворитель в разбавленных растворах, можно представить в следующем виде:
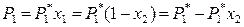 ,
, 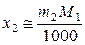 ,
,
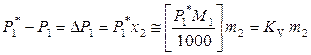 , (9.55)
, (9.55)
где постоянная K V определяется только свойствами растворителя и температуры.
2. Понижение температуры замерзания раствора. Для разбавленных растворов
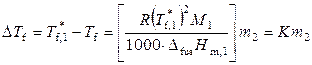 ,
,
где криоскопическая постоянная К определяется только свойствами растворителя.
3. Повышение температуры кипения раствора нелетучего вещества. Для разбавленных растворов
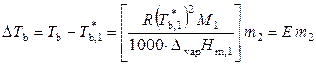 ,
,
где эбулиоскопическая постоянная Е определяется только свойствами растворителя.
4. Осмотическое давление раствора. Для разбавленных растворов можно принять, что объем раствора равен объему растворителя, тогда
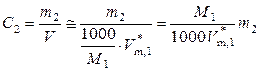 ,
,
где 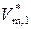 – молярный объем растворителя.
– молярный объем растворителя.
Следовательно, уравнение Вант-Гоффа для осмотического давления разбавленных растворов можно записать следующим образом:
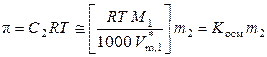 , (9.56)
, (9.56)
где постоянная K осм определяется только свойствами растворителя и температуры.
Итак, рассмотренные свойства (понижение давления пара растворителя, понижение температуры замерзания, повышение температуры кипения раствора нелечучих веществ и осмотическое давление) целиком определяются для разбавленных растворов свойствами растворителя и температуры и линейно зависят только от количества молей растворенного вещества, но не от его природы. Именно такие свойства, линейно зависящие от моляльности, и называются коллигативными.
Следует отметить, что если растворенное вещество диссоциирует (растворы электролитов) или ассоциирует (водные растворы органических кислот) в растворе, то в вышеприведенные формулы вводится изотонический коэффициент:
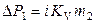 ,
, 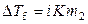 ,
, 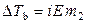 ,
, 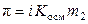 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 588; Нарушение авторских прав?; Мы поможем в написании вашей работы!