
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородная связь
|
|
|
|
С увеличением деформируемости аниона может произойти полный переход электронов от него к катиону, т.е. образуется ковалентная связь. Наоборот, чем меньше поляризация иона, тем ближе соединение к ионному типу.
Наибольшее поляризующее действие оказывают те ионы, которые слабо поляризуются.
Если катион легко деформируется, то возникший в нём диполь усиливает его поляризующее действие на анион; анион, в свою очередь, оказывает дополнительное воздействие на катион – возникает дополнительный поляризационный эффект. Дополнительный поляризационный эффект и тем самым суммарное поляризующее действие особенно велики для 18- электронных катионов(Zn2+,Cd2+,Hg 2+ и др.). Увеличение стягивания ионов в результате их поляризации приводит к тому, что длина диполя оказывается меньше межъядерного расстояния. Например, в молекуле KCl длина диполя составляет 167пм, а межъядерное расстояние – 267пм. Особенно велики различия у водородсодержащих соединений. Расстояние между ядрами водорода и галогена меньше радиуса иона галогена. Так, r(Cl-)= 181пм, в то время как расстояние между ядрами элементов равно127пм. В отличие от других катионов проникает внутрь электронной оболочки аниона. Проникновение протона внутрь аниона приводит к уменьшению длины диполя и деформируемости аниона.
Хлорид серебра растворяется в воде хуже хлорида натрия.Радиус Ag+ соизмерим с радиусом Na+, но поляризуемость больше и поэтому в AgCl межъядерное расстояние меньше, а энергия разрыва связи на ионы больше, чем в хлориде натрия.
Повышение температуры обычно способствует поляризации.Чем сильнее поляризация тем ниже температура диссоциации. Разложение CaI2 требует высоких температур, а CuI2 – низких температур, поэтому в обычных условиях CuI2 не существует.
|
|
|
Кислоты Н2СО3 и H2SO3 менее стабильны, чем их соли. Причины: а) очень сильное поляризующее действие Н+;б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому HCO3- и HSO3- менее устойчивы, чем CO32- и SO32-;в) второй протон делает частицу ещё менее устойчивой, поэтому H2CO3 и H2SO3легко теряют воду.
Это также является одной из причин, почему кислородсодержащие кислоты – более сильные окислители, чем их соли.
Деформируемость электронной оболочки влияет и на оптические свойства соединений Поглощение лучей связано с возбуждением внешних электронов. Электронные переходы отвечают тем меньшим энергиям чем более поляризуема частица. Если частица малополяризуема, то возбуждение требует больших энергий, им отвечаеют ультрафиолетовые лучи. Если частица легко поляризуется, то возбуждение требует квантов небольшой энергии, им отвечает видимая часть спектра. В этом случае вещество окрашено. Так PbI2 имеет жёлтую окраску а CaI2 –бесцветен. Среди сульфидов металлов встречается гораздо больше окрашенных соединений чем среди оксидов.В ряду PbCl2 - PbBr2- PbI2 окраска соли углубляется.
При образовании ионной связи электрическое поле иона обладает сферической симметрией и поэтому ионная связь не обладает направленностью и насыщаемостью.
Водородная связь является особым видом химической связи. Известно, что соединения водорода с сильно электроотрицательными неметаллами, такими как F, О, N, имеют аномально высокие температуры кипения. Если в ряду Н2Тe – H2Se – H2S температура кипения закономерно уменьшается, то при переходе от H2S к Н2О наблюдается резкий скачок к увеличению этой температуры. Такая же картина наблюдается и в ряду галогеноводородных кислот. Это свидетельствует о наличии специфического взаимодействия между молекулами Н2О, молекулами HF. Такое взаимодействие должно затруднять отрыв молекул друг от друга, т.е. уменьшать их летучесть, а, следовательно, повышать температуру кипения соответствующих веществ. Вследствие большой разницы в ЭО химические связи H–F, H–O, H–N сильно поляризованы. Поэтому атом водорода имеет положительный эффективный заряд (δ+), а на атомах F, O и N находится избыток электронной плотности, и они заряжены отрицательно (δ-). Вследствие кулоновского притяжения происходит взаимодействие положительно заряженного атома водорода одной молекулы с электроотрицательным атомом другой молекулы. Из-за очень малого размера положительно поляризованного атома водорода и его способности глубоко внедряться в оболочку соседнего (ковалентно с ним не связанного отрицательно поляризованного атома) образуется водородная связь. Благодаря этому молекулы притягиваются друг к другу (жирными точками обозначены водородные связи). Водородная связь весьма распространена и играет важную роль в процессах растворения кристаллизации электролитической диссоциации и других физико-химических процессах.
|
|
|
Молекулы фторида водорода HF в твёрдом жидком и даже в газовом состоянии ассоциированы в зигзаобразные
цепочки (рис.23).
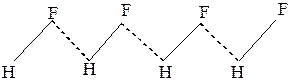

Рис. 23 Водородные связив HF Рис. 24 Водородные связи в Н2О
Молекула воды может образовывать четыре водородные связи так как имеет два атома водорода и две несвязывающие электронные пары(рис.24).
Энергия водородной связи (21–29 кДж/моль или 5–7 ккал/моль) приблизительно в 10 раз меньше энергии обычной химической связи. И тем не менее, водородная связь обусловливает существование в парах димерных молекул (Н2О)2, (HF)2 и муравьиной кислоты. В ряду сочетаний атомов НF, HO, HN, HCl, HS энергия водородной связи падает. Она также уменьшается с повышением температуры, поэтому вещества в парообразном состоянии проявляют водородную связь лишь в незначительной степени; она характерна для веществ в жидком и твердом состояниях. Такие вещества как вода, лед, жидкий аммиак, органические кислоты, спирты и фенолы, ассоциированы в димеры, тримеры и полимеры. В жидком состоянии наиболее устойчивы димеры.
Ни одна из планет Солнечной системы не содержит на своей поверхности такого большого количества воды, как наша Земля. Моря и океаны, средняя глубина которых около 6 км, покрывают 71 % поверхности Земли. Огромное количество воды в виде снега и льда сосредоточено в приполярных районах.
|
|
|
Этот удивительный факт пока не нашел однозначного объяснения. Безусловно, вода играет огромную роль в возникновении и существовании жизни на нашей планете. Во многом это связано наличием межмолекулярных водородных связей. Поэтому вода может находиться в жидком и даже в твердом состоянии (лед) в условиях, в которых похожие соединения водорода с более тяжелыми элементами (серой, селеном и т.д.) газообразны.
Водородные связи приблизительно в 20 раз менее прочные, чем ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар. При температурах выше 0 °С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед, который имеет именно такую упорядоченную структуру. В кристалле льда между молекулами остаются пустоты. Объем этих пустот больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивает свою плотность. Таким образом, водородные связи придают воде еще одно уникальное свойство, без которого вряд ли могла бы существовать разнообразная жизнь в тех районах Земли, где температура зимой понижается ниже 0 °С. Если бы лед тонул в воде, то зимой все водоемы промерзали бы до самого дна. Трудно ожидать, что рыбы согласились бы жить в таких условиях. Человек мог бы растапливать лед, превращая его в воду для своих нужд, но это потребовало бы огромных затрат дополнительной энергии.
|
|
|
 Еще одно красивое проявление водородных связей – голубой цвет чистой воды в ее толще. Когда одна молекула воды колеблется, она заставляет колебаться и связанные с ней водородной связью другие молекулы. На возбуждение этих колебаний расходуются красные лучи солнечного спектра, как наиболее подходящие по энергии. Таким образом, из солнечного спектра "отфильтровываются" красные лучи – их энергия поглощается и рассеивается колеблющимися молекулами воды в виде тепла.
Еще одно красивое проявление водородных связей – голубой цвет чистой воды в ее толще. Когда одна молекула воды колеблется, она заставляет колебаться и связанные с ней водородной связью другие молекулы. На возбуждение этих колебаний расходуются красные лучи солнечного спектра, как наиболее подходящие по энергии. Таким образом, из солнечного спектра "отфильтровываются" красные лучи – их энергия поглощается и рассеивается колеблющимися молекулами воды в виде тепла.
В белом солнечном свете различные цвета как бы уравновешивают друг друга. Поэтому солнечный свет кажется глазу "белым" – лишенным цвета. Если "отфильтровать" лучи одного участка спектра, то начинает проступать другой – в данном случае голубой участок спектра. Он и окрашивает воду в красивый голубой цвет. Но для этого требуется, чтобы солнечный луч прошел не менее чем через 2-х метровую толщу чистой воды и "потерял" достаточно много красных лучей.
 Понять механизм восприятия цвета нашими глазами может помочь "круг цветов",
Понять механизм восприятия цвета нашими глазами может помочь "круг цветов",
Нередко водородная связь объединяет части одной и той же молекулы т.е. является внутримолекулярной. Это характерно для многих органических веществ.
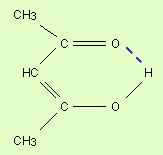
Рис.25 Образование внутримолекулярной водородной связи
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 539; Нарушение авторских прав?; Мы поможем в написании вашей работы!