
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости
|
|
|
|
Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится встречаться с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Вследствие динамического характера равновесия скорость процесса растворения осадка будет совпадать со скоростью обратного процесса кристаллизации. Так, для насыщенного раствора электролита  находящегося в равновесии с его твердой фазой, будет характерен следующий обратимый процесс:
находящегося в равновесии с его твердой фазой, будет характерен следующий обратимый процесс:

Этот процесс является гетерогенным, т.е. протекает на поверхности осадка. Поэтому константа равновесия этого процесса будет определяться только произведением активностей ионов в растворе и не зависит от активности твердого компонента:
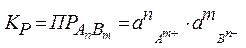 (11.1)
(11.1)
Таким образом, произведение активностей ионов электролита, содержащихся в его насыщенном растворе при данной температуре, есть величина постоянная. Эту величину называют произведением, растворимости электролита и обозначают ПР. Как константа равновесия, произведение растворимости зависит от природы растворенного вещества и растворителя, а также от температуры и не зависит от активностей ионов в растворе.
В настоящее время экспериментальное определение активностей отдельных ионов представляет неразрешимую задачу. Поэтому произведение растворимости применяется для малорастворимых электролитов, т.е. таких электролитов, концентрация насыщенных растворов которых незначительна. Для расчета коэффициентов активности отдельных ионов применяют правило ионной силы или с достаточной степенью точности заменяют активности ионов их концентрациями.
|
|
|
Обычно при характеристике малорастворимого электролита указывают или его растворимость, или произведение растворимости при данной температуре, так как между этими величинами существует тесная связь. Для приведенного выше равновесия связь между ПР и растворимостью ср выразится уравнением
 |
 , (11.2)
, (11.2)
где у— коэффициент активности.
Зная активности ионов малорастворимого электролита в растворе, можно оценить, выпадет ли в данных условиях осадок. Для этого необходимо подставить активности ионов в выражение и полученное значение сравнить со справочным (табличным). Осадок выпадет, если полученное значение произведения активностей ионов превышает табличное.
В соответствии с уравнением при увеличении активности одного из ионов малорастворимого электролита активность второго иона уменьшается. Поэтому, если в раствор малорастворимого электролита внести какой-нибудь хорошо растворимый сильный электролит, содержащий одноименный ион, то растворимость малорастворимого электролита уменьшится. Например, при добавлении  в раствор СаСОз повысится концентрация иона СОз2" и поэтому уменьшится концентрация иона Са2+ и соответственно снизится растворимость СаСОз. Таким методом можно осаждать из раствора малорастворимые электролиты.
в раствор СаСОз повысится концентрация иона СОз2" и поэтому уменьшится концентрация иона Са2+ и соответственно снизится растворимость СаСОз. Таким методом можно осаждать из раствора малорастворимые электролиты.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 464; Нарушение авторских прав?; Мы поможем в написании вашей работы!