
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические и химические свойства металлов
|
|
|
|
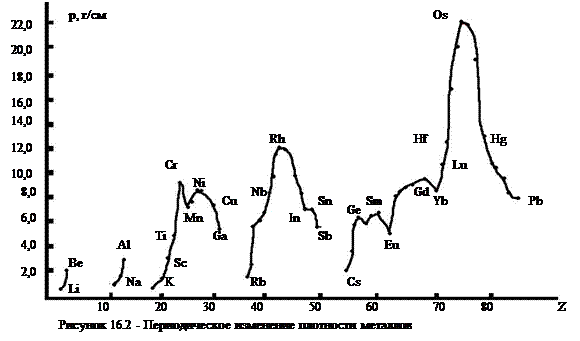 |
Физические свойства металлов. Находящиеся ионы в металлической решетке ионы связаны друг с другом нелокализованными подвижными электронами. Разность энергии молекулярных орбиталей в зоне проводимости металла невелика, поэтому электроны, возбуждаясь, относительно легко переходят из одной орбитали в другую. Этим объясняется высокие электрические проводимость и теплопроводность металлов. Максимально электрическую проводимость имеет серебро, медь, золото и алюминий. Ионы металлов в кристалле могут скользить относительно друг друга. Этим объясняется ковкость (способность к расплющиванию) и пластичность (способность вытягиваться в проволоку и ленту). Плотность металлов, как и других простых веществ находится в периодической зависимости от порядкового номера элемента.
К легким (r £ 5 г/см3) относятся s-металлы и алюминий, скандий и титан, минимальную плотность имеет литий (r = 0,53 г/см3), к тяжелым относятся в основном d-металлы 5-7 периодов. Максимальную плотность имеет осмий (r = 22,6 г/см3). Температура плавления металлов также имеет периодическую зависимость от порядкового номера элемента (рис. 3). К легкоплавким относятся в основном s- и р-металлы, а также d-металлы II группы. К тугоплавким (tпл выше1500°С принадлежат, в основном, d-металлы IV — VIII групп. Минимальную температуру плавления имеет ртуть (tпл =-36,6°С), максимальную - вольфрам ( tПЛ = 3380°С).
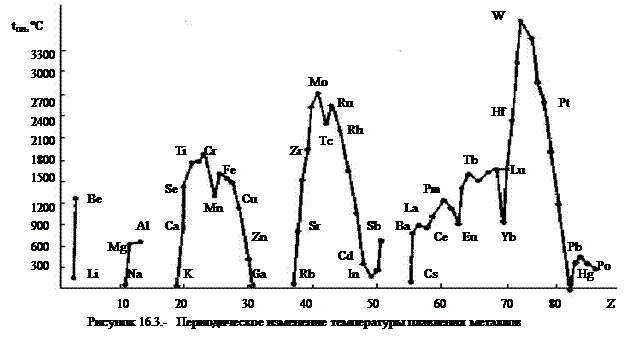
Физико-химические свойства металлов. Вследствие ненасыщенности и ненаправленности металлической связи для кристаллических решеток металлов характерна высокая плотность упаковки. Большинство металлов кристаллизуется в гексагональных или кубических (гранецентрированных или объемно центрированных) решеток. Так как разница энергий решеток металлов относительно невелика, то большинство металлов полиморфны. Например, железо имеет четыре модификации: α(tпер=769ºС), β(tпер=910ºС), γ(tпер=1400ºС) и δ(tпер=1539ºС).
|
|
|

Как известно о степени неупорядоченности можно судить по энтропии. Энтропия металлов находится в периодической зависимости от порядкового номера элемента (рисунок 16.4), причем эта зависимость в значительной степени обратна ходу кривых температур плавления – порядковый номер элемента (см. рис.3). Высокую энтропию имеют калий, цезий, рубидий, f- элементы, жидкая ртуть. Минимальная энтропия [ниже 30Дж/(моль·К)] у бериллия, алюминия, железа, хрома, молибдена, рутения, вольфрама и осмия.
Все металлы – восстановители. О восстановительных способностях металлов судят по электродным потенциалам, значения которых также являются периодической функцией порядкового номера элемента. Так как потенциалы зависят не только от природы металлов и раствора, но и от степени окисления его ионов, то сравнение потенциалов необходимо проводить при одинаковой, либо при максимальной степени окисления. Однако, пока это невозможно из-за отсутствия всех термодинамических данных. Поэтому приведенные на рисунке 16.5 стандартные потенциалы относятся к ионам со степенью окисления либо равной номеру группы, либо указанной на графике. Как видно, к наиболее сильным восстановителям относятся щелочные и щелочноземельные металлы, бериллий, магний, 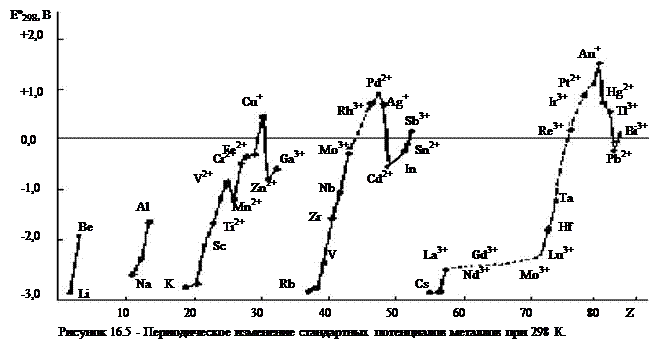
алюминий, лантаноиды и d-металлы III и IV групп. Наиболее положительные электродные потенциалы имеют d-металлы I группы и платиновые металлы.
Химические свойства металлов. Будучи восстановителями, металлы могут взаимодействовать с окислителями. Термодинамическая возможность реакции металла с тем или иным окислителем определяется условием DG<0 или Еок/в>ЕМn+/М, где Еок/в и ЕМn+/М - потенциалы окислителя и металла. Сравнение ряда потенциалов окислителей
|
|
|
F2/F- Cl2/Cl- Br2/Br- O2/OH- H2O,H+/H2
+2.87 +1.36 +1.07 +1.23(pH 0) 0.0 (pH 0)
+0.80(pH 7) -0.42(pH 7)
с электродными потенциалами металлов приводит к следующим выводам. Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме платины и золота) могут окисляться бромом и кислородом в кислой среде. В нейтральной среде кислород не может окислять золото, платиновые металлы, ртуть серебро. Ионы водорода в кислой среде могут окислять многие металлы, кроме платиновых, ртути, серебра, золота, меди, рения, сурьмы и висмута. Реальная возможность того или иного металла определяется не только термодинамикой, но и кинетикой процесса. Взаимодействие многих металлов с хлором, бромом, кислородом, ионами водорода и другими окислителями тормозитсяпассивными пленками на поверхности металлов. Большой склонностью к пассивации обладают бериллий, алюминий, d-металлы IV-VIII групп. Многие металлы катализируют различные химические и электрохимические реакции. На рисунке 16.6 приведены значения логарифмов плотностей тока обмена (константы скорости реакции) выделения водорода в кислых растворах. Как видно, наблюдается периодическая зависимость константы скорости реакции от порядкового номера элемента, максимальная скорость реакции наблюдается на d-металлах VIII группы. Высокую

каталитическую активность проявляют эти металлы и в других реакциях.
Пыль и пары некоторых металлов токсичны. Как известно, токсичность характеризуется предельно-допустимыми концентрациями веществ в рабочей зоне, ПДК (мг/м3). К наиболее токсичным относятся металлы (ПДК - мг/м3): Be(10-3), Hg(10-3), Pb(10-2), Cd(10-2), Ag(10-2), Ni, Rh, Tl, In(10-1).
Так как металлы и их катионы имеют вакантные молекулярные орбитали, то большинство из них являются комплексообразователями и соответственно входят в состав комплексных соединений. Способность к комлексообразованию растет с увеличением заряда иона и уменьшением его радиуса, зависит от природы металла и наличия вакантных орбиталей у его ионов. Наиболее выражена склонность к комплексообразованию у ионов переходных металов, особенно d-элементов VIII, I и II группы.. комплексные соединения, особенно железа, кобальта, меди, марганца, хрома, ванадия, цинка и молибдена, входят в состав биологических систем, включая ферменты, переносчики крови и т.д. Например, в гемоглобин крови входит комплексное соединение железа.
|
|
|
Итак, химические свойства металлов находятся в периодической зависимости от их порядковых номеров.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 528; Нарушение авторских прав?; Мы поможем в написании вашей работы!