
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественный анализ. Химические методы анализа
 |
Общие понятия. Определение содержания (концентрации, массы и т.д.) компонентов в анализируемом веществе называется количественным анализом. С помощью количественного анализа выявляют массовые соотношения компонентов в анализируемом образце, концентрацию вещества в растворе или в газе. При количественном анализе измеряют те или иные химические, физико-химические и физические параметры анализируемого образца, которые зависят от его состава или содержания того иного компонента. В большинстве методов полученные при анализе результаты сравнивают со свойствами известных веществ. Результаты анализа обычно выражают в массовых долях, в %.
Количественный анализ проводят в определенной последовательности, в которую входит отбор и подготовка проб, проведения анализа, обработка и расчет результатов анализа. Как и в качественном анализе, различают макрометоды, полукмикрометоды, микро - и ультрамикрометоды.
Количественный анализ широко используется для изучения состава руд, металлов, неорганических и органических соединений. В последние годы особое внимание обращается на определение содержание токсичных веществ в воздухе, водоемах, почвах, в продуктах питания, различных товарах.
Классификация методов количественного анализа. Все методы количественного анализа можно разделить на две группы химические и инструментальные. Это разделение условно, так как многие инструментальные методы основаны на использовании химических законов и свойств веществ. Обычно количественные методы анализа классифицируют по измеряемым физическим или химическим свойствам.
Таблица 18.3 - Основные методы количественного анализа
|
|
|
| Измеряемая величина (свойство) | Название метода | Масса вещества, доступная измерению | Теоретические основы метода (см. параграф или главу) |
| Масса Объём Плотность Поглощение или испускание инфра- красных лучей Колебания молекул Поглощение или испускание види - мых, ультрафиоле- товых и рентгенов- ских лучей. Колебания атомов. Рассеяние света Диффузионный ток на электроде Электродный по- тенциал Количество электричества Электрическая проводимость Радиоактивность Скорость реакции Тепловой эффект реакции Вязкость Поверхностное натяжение Понижение темпе- ратуры замерзания Повышение темпе- татуры кипения | Гравиметрический Масс-спектрометри- ческий Титрометрический Газоволюметрический Денсиметрический Инфракрасная спектроскопия Комбинационное рассеяние Спектральный и рент- геноспектральный Фотометрический (колориметрия, спек- трофотометрия и дру- гие) Атомно- адсорбционная спек- троскопия Люминесцентный Полярография и вольт- амперометрия Потенциометрический Кулонометрический Кондуктомерический Радиоактивных инди- каторов Кинетический Каталический Термометрия и калориметрия Вискозиметрический Тензометрический Криоскопический Эбулиоскопический | От макро- до ультрамикроколичеств Микроколичества От макро-до ультрамикро - количеств То же Макро - и микроколичества То же То же Полумикро- и микроколи- чества То же Микроколичества То же Полумикро- и микроколичества Макро - и микроколичества Микро - и ультрамикро- количества Макро- и микроколичества От макро- до ультрамикро- количеств Макро - и микроко- личества Макроколичества То же » » » | Параграф 8.6 - Гл. 8 Гл. 8 - Параграф 1. 1, 7.4 - Параграф 1.1-1.3,7.4 Параграф 2.4, 2.5, 3.4 - - Параграф 9.5 Параграф 9.3, 9.4 Параграф 9.2 Параграф 8.4 Гл.17 Параграф 7.1-7.3 Параграф 7.5 Параграф 5.1 - Параграф 4.3, 6.2 Параграф 8.1 Параграф 8.1 |
|
|
|
В учебнике будут рассмотрены лишь некоторые методы, основанные на теоретических положениях, изученных в предыдущих главах.
Гравиметрический метод. Сущность метода заключается в получении труднорастворимого соединения, в которое входит определяемый компонент. Для этого навеску вещества растворяют в том или ином растворителе, обычно в воде, осаждают с помощью реагента, образующего с анализируемым соединением малорастворимое соединение с низким значением ПР (см. параграф 8.3). Затем после фильтрования осадок высушивают, прокаливают и взвешивают. По массе вещества находят массу определяемого компонента и проводят расчет его массовой доли в анализируемой навеске. Некоторые реагенты (групповые и индивидуальные) были рассмотрены в параграфе 16.1.
Имеются разновидности гравиметрического метода. В методе отгонки анализируемый компонент выделяют в виде газа, который взаимодействует с реактивом. По изменению массы реактива судят о содержании определяемого компонента в навеске. Например, содержание карбонатов в породе можно определить путем воздействия на анализируемый образец кислотой, в результате которого выделяется СО2:
СО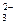 +2Н
+2Н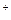
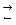 Н2СО3
Н2СО3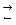 Н2О+СО2
Н2О+СО2
Количество выделившегося СО2 можно определить по изменению массы вещества, например СаО, с которым реагирует СО2.
Одним из основных недостатков гравиметрического метода является его трудоемкость и относительно большая продолжительность. Менее трудоемким является электрогравиметрический метод, при котором определяемый металл, например медь, осаждают на катоде (платиновой сетке)
Cu 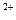 + 2
+ 2 = Cu
= Cu
По разности массы катода до и после электролиза определяют массу металла в анализируемом растворе. Однако этот метод пригоден лишь для анализа металлов, на которых не выделяется водород (медь, серебро, ртуть).
|
|
|
Титриметрический анализ. Сущность метода заключается в измерении объема раствора того или иного реагента, израсходованного на реакцию с анализируемым компонентом. Для этих целей используют так называемые титрованные растворы, концентрация которых (обычно титр раствора) известны. Титром называется масса вещества, содержащегося в 1 мл (1см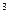 ) титрованного раствора (в г/мл и г/см
) титрованного раствора (в г/мл и г/см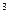 ).Определение проводят способом титрования, т.е. постепенного приливания титрованного раствора к раствору анализируемого вещества, объем которого точно измерен. Титрование прекращается при достижении точки эквивалентности, т.е. достижения эквивалентности реагента титруемого раствора и анализируемого компонента.
).Определение проводят способом титрования, т.е. постепенного приливания титрованного раствора к раствору анализируемого вещества, объем которого точно измерен. Титрование прекращается при достижении точки эквивалентности, т.е. достижения эквивалентности реагента титруемого раствора и анализируемого компонента.
Существует несколько разновидностей титриметрического анализа: кислотно-основное титрование, осадительное титрование, комплексонометрическое титрование и окислительно-восстановительное титрование.
В основе кислотно-основного титрования лежит реакция нейтрализации
Н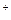 +ОН
+ОН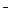
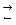 Н2О
Н2О
Метод позволяет определить концентрацию кислоты или катионов, гидролизирующихся с образованием ионов водорода, титрованием раствором щелочи или определить концентрацию оснований, в том числе анионов, гидролизирующихся с образованием гидроксид-ионов титрованием растворами кислот. Точка эквивалентности устанавливается при помощи кислотно-основных индикаторов, изменяющих окраску в определенном интервале рН. Например, методом кислотно-основного титрования можно определить карбонатную жесткость воды, т.е. концентрацию НСО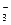 в воде путем титрования ее раствора HCl в присутствии индикатора метилового оранжевого
в воде путем титрования ее раствора HCl в присутствии индикатора метилового оранжевого
НСО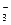 + Н
+ Н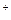 = Н2О+ СО2
= Н2О+ СО2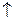
В точке эквивалентности желтая окраска индикатора переходит в бледно-розовую. Расчет производится по уравнению закона эквивалентов
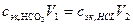 , (18.2)
, (18.2)
где 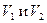 -объемы анализируемого и титрованного растворов;
-объемы анализируемого и титрованного растворов;
|
|
|
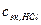 - нормальная концентрация эквивалентов вещества HCl в титрованном растворе
- нормальная концентрация эквивалентов вещества HCl в титрованном растворе
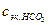 - определяемая молярная концентрация эквивалентов ионов НСО
- определяемая молярная концентрация эквивалентов ионов НСО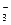 в анализируемом растворе.
в анализируемом растворе.
При осадительном титровании анализируемый раствор титруется реагентом, образующим с компонентом титрованного раствора малорастворимое соединение. Точка эквивалентности определяется с помощью индикатора, образующего с реагентом окрашенное соединение, например, красный осадок Ag2CrO4 при взаимодействии индикатора K2CrO4 с избытком ионов Ag 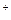 при титровании раствора хлорида раствором нитрата серебра.
при титровании раствора хлорида раствором нитрата серебра.
Комплексонометрическое титрование. При комплексонометрическом титровании определяемый компонент в растворе титруется раствором комплексона, чаще всего этилендиаминотетрауксусной кислоты (ЕДТА, комплексона II) или ее двунатриевой соли (комплексона III или трилона Б). Комплексоны являются лигандами и образуют со многими катионами комплексы. Индикаторами мочки эквивалентности обычно служат лиганды, образующие с анализируемым ионом окрашенное комплексное соединение. Например, индикатор хромоген черный с кальцием и магнием образует комплексы 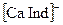 и
и 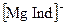 красного цвета. В результате титрования раствора винно-красного цвета, содержащего ионы кальция, магния и индикатор, раствором комплексона III кальций связывается в более прочный комплекс с комплексоном, в точке эквивалентности анионы индикатора освобождаются и придают раствору синюю окраску. Этот метод комплексонометрического титрования используются, например, для определения общей жесткости воды.
красного цвета. В результате титрования раствора винно-красного цвета, содержащего ионы кальция, магния и индикатор, раствором комплексона III кальций связывается в более прочный комплекс с комплексоном, в точке эквивалентности анионы индикатора освобождаются и придают раствору синюю окраску. Этот метод комплексонометрического титрования используются, например, для определения общей жесткости воды.
Окислительно-восстановительное титрование. Данный способ заключается в титровании раствора восстановителя титрованным раствором окислителя или в титровании раствора окислителя титрованным раствором восстановителя. В качестве титрованных растворов окислителей нашли применение растворы перманганата калия KMnO4 (перманганатометрия), дихромата калия K2Cr2O7 (дихроматометрия), иода I2 (иодометрия). Из титрованных растворов восстановителей следует отметить растворы гидразина N2H4 (гидразинометрия).
При перманганатометрическом титровании в кислой среде Mn (VII) (малиновая окраска) переходит в Mn (II) (бесцветный раствор). Например, перманганатометрическим титрованием можно определить содержание нитритов в растворе
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O
При дихроматометрическом титровании индикатором служит дифениламин, окрашивающий раствор в синий цвет при избытке дихромат-ионов. При иодометрическом титровании индикатором служит крахмал. Иодометрическое титрование используется для анализа растворов окислителей, в этом случае титрованный раствор содержит иодид-ион. Например, медь можно определить титрованием ее растворов раствором иодида
2Cu
Затем образующийся раствор титруется титрованным раствором тиосульфата натрия Na2S2O3 c индикатором крахмалом, добавляемым в конце титрования
2Na2S2O3 + I2 = 2NaI + Na2S4O6
Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титрометрические и гравиметрические методы.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2656; Нарушение авторских прав?; Мы поможем в написании вашей работы!