
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные характеристики химической связи
|
|
|
|
Основными характеристиками химической связи являются длина, валентные углы, энергия, дипольный момент.
Под длиной связи А∙∙∙В понимают расстояние между атомами (межъядерное расстояние), отвечающее устойчивому состоянию молекулы. Грубая оценка длины связи А∙∙∙В может быть проведена на основе соотношения:
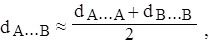
если известны межатомные расстояния в молекулах А2 и В2.
Закономерное изменение атомных и ионных радиусов в таблице Менделеева ведет к закономерному изменению длин связей, например (длины связей выражены в пм):
| H2 | F2 | Cl2 | Br2 | I2 |
| S2 | Se2 | Te2 |
| H–O | H–S | H–Se | H–Te |
Для данного типа связи при сохранении валентности элемента длина связи примерно сохраняется, например:
О–Н в Н2О 97 пм
Н2О2 97 пм
НСООН 96 пм
Рост кратности связи ведёт к её укорочению, например:
С–С 154 пм
С=С 134 пм
С≡С 120 пм
Под энергией связи (энтальпией связи) подразумевают энергию разрыва 1 моль данной связи до состояния атомов, при этом атомы разводятся на бесконечно большое расстояние. Например:
СО(г) = С(г) + О(г); DН0298 = 1068 кДж/моль = DН0связи;
Н2(г) = 2Н(г); DН0 = DН0связи = DН0дисс. Н2 на атомы = DН0атомизации
Под средней энергией (энтальпией) связи А∙∙∙В в молекуле АВn понимают 1/n часть энергии разрыва всех связей А∙∙∙В в 1 моль соединения АВn, при этом атомы разводятся на бесконечно большое расстояние. Например:
NH3(г) = N(г) + 3H(г); DН0298 = 1155 кДж/моль;
DН0ср. N–H = 1155/3 = 385 кДж/моль связи
Вычисление энтальпий связей производят на основе закона Гесса. Энтальпии связей закономерно изменяются в соответствии с таблицей Менделеева, например:
N–H O–H F–H
|
|
|
385 464 565 кДж/моль связи
O2 S2 Se2
494 427 272 кДж/моль связи
Рост кратности связи ведёт к увеличению энтальпии связи, например:
С–С С=С С≡С
343 612 815 кДж/моль связи
Дипольный момент связи (m) представляет собой произведение эффективного заряда атома на межъядерное расстояние:
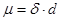
Дипольный момент связи – векторная величина. Дипольный момент молекулы равен сумме векторов дипольных моментов связей, входящих в молекулу, с учётом неподелённых электронных пар. Наиболее часто дипольные моменты измеряют в Дебаях (D), 1 D = 3,3×10–30 Кл×м. Дипольные моменты молекул закономерно изменяются в соответствии с таблицей Менделеева, например:
NH3 PH3 AsH3
1,48 0,58 0,13 D
CsF CsCl CsI
7,9 10,4 12,1 D
Следует подчеркнуть, что в большинстве случаев эффективный заряд атома и межъядерное расстояние в подгруппах изменяются в противоположных направлениях и трудно выделить доминирующий компонент. Так, в первом приведенном примере эффективный заряд в подгруппе падает энергичнее, чем нарастает радиус атома, а во втором примере – наоборот. Чем симметричнее молекула, тем меньше у неё дипольный момент. Симметричные молекулы (CO2; BCl3; CCl4; PCl5; SF6) неполярны и имеют m=0.
Валентные углы связей определяют экспериментально. Познакомимся с несколькими приближёнными методами теоретического описания геометрии молекул.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 809; Нарушение авторских прав?; Мы поможем в написании вашей работы!