
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибридные представления
|
|
|
|
Несколько различных, но не сильно отличающихся по энергии орбиталей заменяются таким же числом одинаковых по энергии, а значит и симметрично расположенных в пространстве орбиталей. Реально в гибридную комбинацию берут орбитали одного слоя, например, 2s- и 2р-орбитали; 4s-, 4р- и 4d-орбитали или d-орбитали предшествующего слоя с s- и р-орбиталями последующего слоя. Именно в таких комбинациях орбитали характеризуются близкими значениями энергии.
Качественно идеологию гибридизации проиллюстрируем на примере комбинации из s- и р-орбиталей. Одна s- и одна р-орбиталь дают две гибридные орбитали:
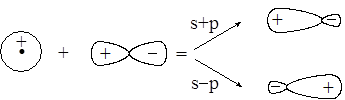
Как видно, гибридная орбиталь более вытянута в сторону связи, следовательно перекрывание будет более сильным, а связь более прочной по сравнению со связью, образуемой негибридной орбиталью.
Остановимся на основных вариантах гибридных комбинаций, используемых при описании химических связей. Из одной s- и одной р-орбитали можно построить две sp-гибридные орбитали, располагающиеся под углом 180o

и ведущие к прямолинейной геометрии молекулы или её фрагмента. Примерами молекул, для описания химической связи в которых применяют представления об sp-гибридизации, являются галогениды бериллия, ацетилен и его производные.
Одна s- и две р-орбитали позволяют построить три sр2-гибридные орбитали, располагающиеся под углом 120o
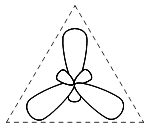
и ведущие к геометрии правильного треугольника. sр2-Гибридные комбинации используют для описания связей, например, в соединениях бора и органических молекулах, содержащих двойные связи углерод–углерод.
Одна s-орбиталь в комбинации с тремя р-ориталями позволяет организовать четыре sр3-гибридные орбитали, ориентированные по тетраэдру
|
|
|

и ведущие к валентным углам в 109o28¢.
Комбинация из одной s-орбитали, одной d-орбитали и двух р-орбиталей позволяет получить четыре dsp2-гибридные орбитали, которым соответствует расположение партнёров относительно центрального атома по вершинам квадрата. Этот вариант гибридных представлений широко используется при описании химической связи в комплексных соединениях.
С использованием d-орбиталей употребляются гибридные комбинации dsp3 и d2sp3 (sp3d2). В первом случае пять одинаковых орбиталей направлены к вершинам правильной тригональной пирамиды, а во втором – к вершинам октаэдра.
Квантово-химические расчёты показывают, что более двух d-орбиталей использовать в гибридной комбинации невыгодно. Поэтому для описания семи и восьми одинаковых связей (например, в комплексах) привлекают в гибридные комбинации f-орбитали: d2sp3f и d2sp3f 2.
Строгие расчёты показывают, что перестройка обычных орбиталей в гибридные даёт солидный выигрыш при n=2; эффективна в большинстве случаев при n=3; малоэффективна при n=4,5,6,7. Это означает, что гибридные представления следует смело использовать в отношении атомов элементов второго периода; с некоторой осторожностью – в отношении атомов элементов третьего периода, а для атомов элементов 4, 5, 6, 7 периодов не следует применять гибридные представления.
Подчеркнём ещё, что в гибридную комбинацию практически всегда включают свободные (неподелённые) электронные пары, имеющиеся у атома, в отношении связей которого применяются гибридные представления.
Таким образом, для нахождения типа гибридизации орбиталей атома следует просуммировать число его партнёров по химической связи и число свободных электронных пар. Если эта сумма равна двум – sp-гибридизация, трём – sp2-гибридизация, четырём – sp3-гибридизация, пяти – dsp3-гибридизация и т.д. Так, для молекул воды и аммиака эта сумма равна четырём (для воды 2+2, для аммиака 3+1). Таким образом, описывать химическую связь в этих молекулах надо исходя из модели sp3-гибридизации. Из четырёх гибридных орбиталей в случае молекулы воды две заняты свободными электронными парами, а в случае молекулы аммиака одна орбиталь занята свободной электронной парой. В результате делается вывод, что молекула воды – уголковая, угол Н–О–Н тетраэдрический; молекула аммиака имеет форму неправильной тригональной пирамиды с атомом азота в одной из вершин, угол Н–N–Н тетраэдрический. Сравнение полученных результатов с экспериментальными данными показывает, что гибридные представления более точно описывают эти молекулы, чем классический метод ВС (рис. 3.6).
|
|
|

Рис. 3.6. Схемы перекрывания орбиталей при образовании связей в молекулах воды и аммиака
Теперь обратимся к молекуле с кратными связями, например, СО2. У атома углерода два партнёра по химической связи, свободных электронных пар нет. Отсюда вытекает гибридная комбинация – sp. Из четырёх электронов углерода два использованы на образование гибридных орбиталей, два других образуют p-связи (рис. 3.7).
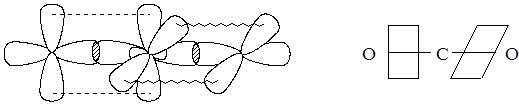
Рис. 3.7. Схемы перекрывания орбиталей при образовании связей в молекуле СО2
Иногда упрощённо на схеме перекрывания s-связи изображают прямыми отрезками, а p-связи плоскостями, проходящими через максимумы перекрывания.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1901; Нарушение авторских прав?; Мы поможем в написании вашей работы!