
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи и упражнения
|
|
|
|
Пример 11. В следующих молекулах и ионах указать, сколько связей образовано по донорно-акцепторному механизму: Be2Cl4; Al2Cl6; NH4+; BF4–; SiF62–.
Решение. Как уже говорилось, представления о донорно-акцепторном взаимодействии привлекаются для описания химических связей в тех случаях, когда их число превышает валентные возможности атомов.
Молекула хлорида бериллия – линейна, химическая связь в ней описывается исходя из представлений об sp-гибридизации орбиталей центрального атома. В парах это соединение димеризовано, энергия Гиббса процесса
2 BeCl2 (г)  Be2Cl4 (г)
Be2Cl4 (г)
отрицательна. Внешний электронный слой атома бериллия в хлориде заполнен лишь наполовину и может принять еще две пары электронов от двух атомов хлора второй молекулы BeCl2 за счет донорно-акцепторного взаимодействия. Сказанное справедливо и для второй молекулы BeCl2:
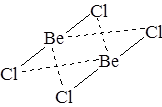
В результате суммарное количество связей, образованных по донорно-акцепторному механизму, составляет в молекуле Be2Cl4 четыре.
Сходная ситуация наблюдается и в хлориде алюминия: внешний слой содержит (после образования трех связей с атомами хлора) шесть электронов и может принять еще пару электронов по донорно-акцепторному механизму от атома хлора второй молекулы хлорида алюминия:

Более того, поскольку атом алюминия имеет пустые d-орбитали, можно их заполнить электронными парами от других атомов хлора:
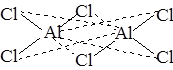
В результате приходим к выводу, что при образовании молекулы Al2Cl6 число связей, образованных по донорно-акцепторному механизму, не менее двух и не более шести. Первый вариант объяснения соответствует sp3-гибридному состоянию орбиталей атома алюминия (этот же вариант гибридизации орбиталей атома бериллия используется для описания химической связи в Be2Cl4). Второй – sp3d2-гибридному состоянию орбиталей атома алюминия.
|
|
|
В ионе аммония NH4+ имеется одна связь, образованная по донорно-акцепторному механизму за счёт свободной электронной пары молекулы аммиака и пустой 1s-орбитали протона.
Также одна связь образована по обсуждаемому механизму в ионе BF4–, в этом случае донором электронной пары является фторидный анион, свободная электронная пара которого поставляется на пустую орбиталь атома бора.
В ионе SiF62– две связи образованы по донорно-акцепторному механизму.
Пример 12. Изобразить схемы перекрывания орбиталей при образовании связей в молекулах CH3OH; C2H6; C2H4; C2H2; HCN.
Решение. Для описания химических связей атома углерода (элемент второго периода) во всех предлагаемых молекулах используем гибридные представления.
Для метильной группы метанола используем представление об sp3–гибридизации (четыре партнера по химической связи и нет свободных пар). ОН-группа, входящая в состав молекул спиртов и карбоновых кислот, является “осколком” молекулы воды, для описания химической связи которой привлекаются представления о sp3-гибридизации (рис. 3.6). Отсюда получаем:
Для описания связи в молекуле этана (два метила), естественно, используем представления о sp3-гибридизации орбиталей атомов углерода. В результате схема перекрывания орбиталей при образовании связей в этой молекуле представится двумя тетраэдрами, соединенными вершинами:

В молекуле этилена каждый атом углерода связан с тремя партнерами по химической связи, свободных электронных пар у них нет; негибридная р-орбиталь используется для образования π-связи:

В молекуле ацетилена у каждого атома углерода два партнёра по химической связи, свободных электронных пар нет; две негибридные орбитали используются для образования двух π-связей:

Такой же вариант гибридизации орбиталей атома углерода используем и для описания связи в молекуле циановодорода, негибридные орбитали атома углерода вместе с р-орбиталями атома азота образуют две π-связи:
|
|
|

Пример 13. На основе метода Гиллеспи предскажите геометрию следующих молекул и ионов: SO2; SO3; PCl3; PCl5; XeF4; O3; BF4–; PF6–.
Решение. SO2; n=2;  ; AB2E1. Исходная модель для рассмотрения молекулы SO2 – правильный треугольник.
; AB2E1. Исходная модель для рассмотрения молекулы SO2 – правильный треугольник.
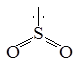
Сама молекула уголковая с углом около 120о.
У атома серы в молекуле SO3 нет свободных электронных пар: 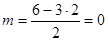 ; AB3E0. Молекула имеет форму правильного треугольника, в вершинах которого стоят атомы кислорода, а в центре – атом серы.
; AB3E0. Молекула имеет форму правильного треугольника, в вершинах которого стоят атомы кислорода, а в центре – атом серы.
У фосфора на внешнем слое пять электронов, поэтому для PCl3 запишем AB3E1;  . Исходной моделью для рассмотрения геометрии этой молекулы является тетраэдр, а молекула представляет собой треугольную пирамиду, в одной из вершин которой находится атом фосфора:
. Исходной моделью для рассмотрения геометрии этой молекулы является тетраэдр, а молекула представляет собой треугольную пирамиду, в одной из вершин которой находится атом фосфора:

А вот молекула PCl5 будет симметричной в силу отсутствия у атома фосфора свободных (неподелённых) электронных пар: 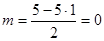 . Для неё запишем АВ5E0 и сделаем вывод, что указанная молекула представляет собой тригональную бипирамиду, в которой расстояния от атома фосфора до атомов хлора одинаковы:
. Для неё запишем АВ5E0 и сделаем вывод, что указанная молекула представляет собой тригональную бипирамиду, в которой расстояния от атома фосфора до атомов хлора одинаковы:

На внешнем электронном слое атома ксенона находится восемь электронов, поэтому для XeF4 запишем АВ4E2;  . Таким образом, исходная модель – октаэдр, возможны два варианта:
. Таким образом, исходная модель – октаэдр, возможны два варианта:

I II
Первая модель по энергетическим соображениям представляется более выгодной, поэтому приходим к выводу, что молекула XeF4 имеет форму квадрата с центром в виде атома ксенона.
При рассмотрении молекулы озона следует не забывать, что у центрального атома кислорода есть свободная электронная пара, тогда относительно него запишем: АВ2E1,  . Исходная модель – правильный треугольник, а молекула озона – уголковая с углом около 120о.
. Исходная модель – правильный треугольник, а молекула озона – уголковая с углом около 120о.
У атома бора в анионе BF4– нет свободных электронных пар, n=4; m=0. Ион имеет форму тетраэдра. Аналогично и у атома фосфора в анионе PF6– нет свободных электронных пар, n=6; m=0. Анион имеет форму октаэдра. В этих анионах по одной связи образовано по донорно-акцепторному механизму: анион F– поставляет свободную электронную пару на пустую орбиталь атома бора или фосфора соответственно.
Пример 14. Какие из перечисленных молекул являются полярными: CO2; H2O; SnCl2; CHCl3; PF5; BF3?
|
|
|
Решение. Молекулы полярны, если их дипольные моменты не равны нулю. В свою очередь дипольный момент молекулы представляет собой векторную сумму дипольных моментов связей, при этом необходимо учитывать вклад неподеленных электронных пар. Таким образом, дипольный момент молекулы определяется не только полярностью отдельных связей, но и их расположением в пространстве, т. е. геометрией молекулы. Симметричные молекулы, имеющие одинаковые связи, неполярны и имеют μ=0.
Для ответа на поставленный вопрос воспользуемся методом Гиллеспи и определим геометрию молекул (геометрию связей).
Молекула CO2; n=2; 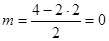 ; линейная молекула. Два вектора дипольных моментов связей углерод–кислород одинаковы и противоположно направлены
; линейная молекула. Два вектора дипольных моментов связей углерод–кислород одинаковы и противоположно направлены

Следовательно, μ=0 и молекула неполярна.
Молекула Н2O; n=2; 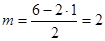 ; исходная модель для рассмотрения геометрии – тетраэдр; сама же молекула – уголковая:
; исходная модель для рассмотрения геометрии – тетраэдр; сама же молекула – уголковая:
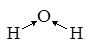
Результат сложения векторов дает положительный дипольный момент молекулы, кроме того в эту величину вносят вклад и свободные электронные пары атома кислорода. В результате приходим к выводу, что дипольный момент молекулы воды не равен нулю μ≠0.
Молекула SnCl2; n=2; 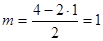 ; исходная модель для рассмотрения геометрии – правильный треугольник; сама же молекула – уголковая. Она будет полярной.
; исходная модель для рассмотрения геометрии – правильный треугольник; сама же молекула – уголковая. Она будет полярной.
Молекула хлороформа; n=4; m=0; тетраэдрическая молекула с разными связями, имеющими различные дипольные моменты, результатом сложения которых будет ненулевой дипольный момент молекулы СНCl3.
Молекулы PF5 и BF3 симметричны, в силу симметрии и одинаковости связей они не будут полярными:
PF5; n=5; m=0; тригональная бипирамида; μ=0:

BF3; n=3; m=0; правильный треугольник; μ=0:

Пример 15. На основе следующих данных определить стандартную энтальпию связи С–С в молекуле этана:
1) ΔНообр С2Н6 (г) = ΔНо1 = –84,7 кДж/моль,
2) Н2 (г) = 2Н (г); ΔНо2 = 436,0 кДж,
3) С(к, графит) = С (г); ΔНо3 = 715,1 кДж/моль,
4) ΔНоС–Н = ΔНо4 = 415,6 кДж/моль
Решение. Запишем исходные данные в виде соответствующих термохимических уравнений.
|
|
|
1) 2С(к, графит) + 3Н2 (г) = С2Н6 (г); ΔНо1,
2) Н2 (г) = 2Н (г); ΔНо2,
3) С(к, графит) = С (г); ΔНо3
Основой для нахождения искомой величины ΔНоС–C является уравнение процесса диссоциации 1 моль газообразного этана на атомы:
5) С2Н6 (г) = 2С (г) + 6Н (г); ΔНо5,
При осуществлении этого процесса разрывается связь С–С и шесть связей С–Н. Таким образом,
ΔНо5 =ΔНоС–С + 6ΔНоС–Н
Термохимическое уравнение 5) получается сложением утроенного второго уравнения с удвоенным третьим и вычитанием из полученной суммы первого термохимического уравнения:
ΔНо5 = 3ΔНо2 + 2ΔНо3 – ΔНо1 = 2822,9 кДж
Тот же результат можно получить, воспользовавшись первым следствием из закона Гесса и обратив внимание на то, что ΔНо2 есть удвоенная стандартная энтальпия образования атомарного водорода, а ΔНо3 – стандартная энтальпия образования газообразного углерода:
ΔНо5 = 6ΔНообрН(г) +2ΔНообрС(г) –ΔНообрС2Н6(г) = 3ΔНо2+2ΔНо3–ΔНо1
Найдя ΔНо5 и зная стандартную энтальпию связи С–Н, находим стандартную энтальпию связи С–С в этане:
ΔНоС–С = ΔНо5 – 6ΔНоС–Н = 329,3 кДж/моль связи
Пример 16. По справочным данным вычислить среднюю стандартную энтальпию связи C–Cl в CCl4 и связи С=О в СО2.
Решение. Термохимические уравнения изучаемых процессов:
СCl4 (г) = С (г) + 4Cl (г); ΔНо1,
СO2 (г) = С (г) + 2O (г); ΔНо2
По следствию из закона Гесса находим:
ΔНо1 = 4ΔНообрCl(г) + ΔНообрС(г) – ΔНообрСCl4(г) = 1302,6 кДж;
ΔНо2 = 2ΔНообрO(г) + ΔНообрС(г) – ΔНообрСO2(г) = 1607,0 кДж
Находим искомые величины:
ΔНоср С–Сl = ΔНо1 / 4 = 325,7 кДж/моль связи;
ΔНоср С=O = ΔНо2 / 2 = 803,5 кДж/моль связи
Пример 17. Изобразить валентные схемы для следующих молекул и ионов, позволяющие объяснить дробную кратность связей: SO3; O3; PO43–; ClO4–.
Решение. Характеристики связи сера–кислород в молекуле SO3 указывают на кратность связи ниже двух. Этот факт может быть объяснён привлечением к рассмотрению валентных схем с однократной связью, например:
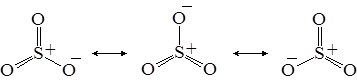
Результатом наложения будет молекула, имеющая форму правильного треугольника с кратностью связи 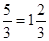 :
:

Если же необходимо объяснять ещё меньшую кратность связи, то следует включить в рассмотрение валентные схемы с двумя однократными связями сера–кислород и т.д.
Строение молекулы озона можно представить как результат наложения двух валентных схем:
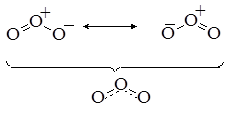
Уголковая геометрия молекулы связана с тем, что у центрального атома кислорода есть одна свободная электронная пара.
Очевидно, строение иона PO43– можно описать результатом наложения четырёх валентных схем:

Фосфат-ион имеет форму тетраэдра, кратность связи фосфор–кислород составляет 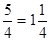 .
.
Аналогичное тетраэдрическое строение имеет и анион ClO4–, описываемый также как результат наложения четырёх валентных схем:
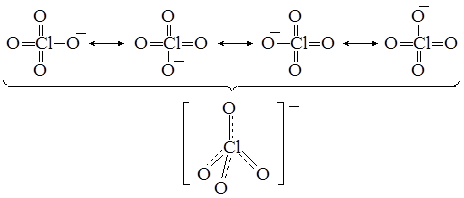
Кратность связи хлор–кислород составляет  .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 7693; Нарушение авторских прав?; Мы поможем в написании вашей работы!