
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические реакции
|
|
|
|
Газовые законы
1. При постоянной температуре T = const (изотермический процесс) давление, производимое данной массой газа, обратно пропорционально объему газа:
pV = const. (2.6)
(закон Р. Бойля и Э. Мариотта).
2. При постоянном давлении р = const (изобарический процесс) изменение объема газа прямо пропорционально абсолютной температуре:
V/T = const. (2.7)
(закон Ж. Гей-Люссака).
3. При постоянном объеме V = const (изохорический процесс) изменение давления прямо пропорционально абсолютной температуре:
p/T = const. (2.8)
(закон Ж. Шарля).
4. Обобщенное уравнение газового состояния:
pV/Т = const. (2.9)
Взаимодействие химических соединений записывается с помощью химических уравнений, отражающих материальный баланс всех реагирующих веществ. Это достигается с помощью стехиометрических коэффициентов перед формулами соединений:

|
где A, B, C, D – реагирующие вещества; a, b, c, d – стехиометрические коэффициенты.
Можно выделить четыре основных типа химических реакций:
Соединения:

|

|

|
Замещения:

|
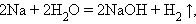
|

|
Разложения:

|
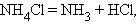
|

|

|
Обмена:

|

|

|
Реакции, сопровождающиеся изменением степени окисления всех или некоторых реагирующих веществ, называются окислительно-восстановительными. Из написанных выше реакций к таковым относятся:

|

|

|

|
Способы получения солей

|
| Рисунок 2.3.1 -Медный купорос, смешиваясь с водой, приобретает ярко-голубой оттенок |
1. Взаимодействие простых веществ
|
|
|

|
2. Взаимодействие оксидов

|
3. Взаимодействие кислот и оснований (нейтрализация)

|
4. Взаимодействие соли и кислоты

|
5. Взаимодействие соли и щелочи

|
6. Взаимодействие двух солей (обменная реакция)
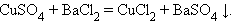
|
7. Взаимодействие оксида с кислотой

|
8. Замещение водорода
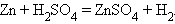
|
9. Замещение металла
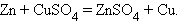
|
10. Термолиз кислых солей

|
11. Взаимодействие двух солей (присоединение)
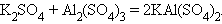
|
12. Взаимодействие двух солей (комплексообразование)

|
Способы получения оксидов

|
| Рисунок 2.3.2 - Лесные пожары – один из источников углекислоты |
1. Окисление простых и сложных веществ
| S + O2 = SO2; 2Mg + O2 = 2MgO, |
2.
| 2CuS +3O2 = 2CuO + 2SO2. |
3. Разложение гидроксидов

|
4. Разложение карбонатов и других солей

|
5.

|
6.

|
7. Взаимодействие металла с другим оксидом
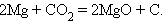
|
Способы получения кислот
1. Взаимодействие кислотного оксида с водой

|
2. Вытеснение летучих кислот

|
3. Взаимодействие соли и кислоты с образованием нерастворимой соли

|
4. Взаимодействие водорода с элементом с образованием бескислородной кислоты
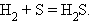
|
5. Комплексные кислоты

|
6.

|
Способы получения оснований

|
| Рисунок 2.3.3 - Несмотря на то, что натрий тяжелее воды, он «бегает» по ее поверхности, подталкиваемый пузырьками водорода, образующимися в результате реакции. В результате образуется гидроокись натрия |
1. Взаимодействие металла с водой

|
2. Взаимодействие оксида с водой
|
|
|
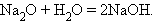
|
3. Разложение соли водой (гидролиз)

|
4. Взаимодействие соли и щелочи

|
Уравнение химической реакции – модель и реальность.
Процесс превращения веществ, сопровождающийся изменением их состава и (или) строения, называется химической реакцией. Суть этого процесса заключается в разрыве химических связей в исходных веществах и образовании новых связей в продуктах реакции. Реакция считается законченной, если вещественный состав реакционной смеси больше не изменяется.
Химическая реакция записывается в виде уравнения, например:
H2 + Cl2 = 2HCl
В уравнениях реакций с участием органических соединений (органических реакциях) знак равенства заменяется стрелкой (т.к. символ равенства "=" совпадает с символом двойной связи):
CH4 + Cl2 ® CH3Cl + HCl;
CH2=CH2 + Br2 ® CH2Br-CH2Br
Далеко не всегда химические реакции строго соответствуют тщательно уравненным уравнениям. Скорее наоборот – в большинстве случаев уравнение отражает либо основной процессов, либо наиболее желательный.
Однозначным уравнением невозможно, например, описать реакции растворения в азотной кислоте многих металлов – одновременно идут процессы образования NO2, NO, N2O, N2. NH4NO3.
В некоторых учебниках и пособиях по химии можно встретить уравнение реакции горения черного (дымного) пороха – самого древнего боевого взрывчатого вещества:
2KNO3 + S +3C = K2S +3CO2+N2
Левая часть уравнения примерно отражает состав реальных порохов. Однако правая часть не согласуется с экспериментальными данными. В продуктах сгорания черного пороха обнаружено не менее 8 твердых и 6 газообразных веществ.
2.4 Вопросы для самоконтроля
1. Что называется химическими реакциями?
2. Какое общее название имеют протоны, нейтроны и электроны?
3. Что называется абсолютной атомной массой?
4. Что такое относительная атомная масса химического элемента? Каким символом она обозначается?
5. Как формулируется закон постоянства состава?
6. Что такое молекула?
7. Что такое относительная молекулярная масса?
8. На какие два типа делятся все вещества?
9. Что такое простые вещества?
10. Какие простые вещества имеют молекулярное строение (названия и формулы)?
11. Какие простые вещества имеют атомное строение? Приведите примеры.
|
|
|
12. Почему число простых веществ больше числа химических элементов?
13. Что такое сложные вещества?
14. Что такое валентность элемента?
15. Что такое моль?
16. Как обозначается и чему равно число Авогадро?
17. Как формулируется первое следствие из закона Авогадро?
18. Что называется молярным объёмом?
19. Чему равен молярный объём любого газа при нормальных условиях?
20. Каким уравнением выражается объединённый газовый закон?
21. Как называется закон, который открыли Ломоносов и Лавуазье?
22. Как формулируется закон сохранения массы веществ?
23. Чем объясняется сохранение массы веществ в химических реакциях?
24. Что такое химическое уравнение?
25. Рассчитайте изменение массы вещества в ходе реакции 2 Al + 3O2 = 2 Al2O3 в результате которой выделилось 3350 103 Дж.
26. Назовите эквивалент ионов олова в приведённых реакциях. Определите массу моля эквивалентов.
а) Sn4+ + 2e = Sn2+
б) Sn4+ + 4ОН– = Sn(ОН)4.
27. Чему равна масса 1 моль эквивалентов ионов Fe3+ в реакциях его восстановления?
а) Fe3+ + е =) Fe2+
б) Fe3+ + 3е = Fe.
28. Рассчитайте длину волны тела массой 1 кг, двигающегося со скоростью м/с, учитывая единицу измерения джоуля [м2 ·кг·с2].
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 750; Нарушение авторских прав?; Мы поможем в написании вашей работы!