
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третий закон термодинамики
|
|
|
|
В 1911 г. Макс Планк предложил следующий постулат: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю. Этот постулат может быть объяснен статистической термодинамикой, согласно которой энтропия есть мера беспорядочности системы на микроуровне:
S = RlnW, (8.9)
где W – число различных состояний системы, доступное ей при данных условиях, или термодинамическая вероятность макросостояния системы;
R = 1,38.10-16 эрг/град, постоянная Больцмана.
Это "уравнение Больцмана", выведено М.Планком в 1900 г,
Очевидно, что энтропия жидкости существенно превышает энтропию твердого тела, а энтропия газа – энтропию жидкости.
Sгаз>>Sж>>Sтв
 Чем сложнее молекула газа, тем больше ее энтропия.
Чем сложнее молекула газа, тем больше ее энтропия.
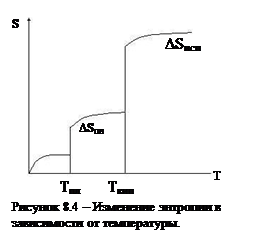
При Т=0 S=0. При повышении Т начинаются колебания атомов и S растет до Тпл.
Далее следует фазовый переход и скачок энтропии DSпл.С повышением Т S плавно и незначительно растет до Тисп, где опять наблюдается резкий скачок DSисп и опять плавное увеличение.
Существенный момент при изучении энтропии: для нее справедлив закон Гесса – изменение энтропии, как и изменение энпальпии, не зависит от пути процесса, а зависит только от начального и конечного состояний
DS=SSкон - SSнач. (8.10)
Знак изменения энтропии часто можно предсказать, исходя их уравнения реакций. Уменьшение количества газовых молей означат уменьшение энтропии и наоборот.
Стандартные значения S. Для энтальпии стандартные значения определяются Т=298 К и давлением 1 атм. Для энтропии этого не достаточно. Энтропия зависит от концентрации. Энтропия газа в банке определенно меньше, чем его же энтропия, после выпуска газа в объем комнаты. Значит, либо для растворов S°отвечает концентрации 1 моль/л. Тогда вполне очевидной становится зависимость энтропии от концентрации, выведенная на основании ее определения:
S= S° - R ln C, (8.11)
где S° - стандартная энтропия.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 278; Нарушение авторских прав?; Мы поможем в написании вашей работы!