
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация слабых электролитов
|
|
|
|
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например, уксусной кислоты:
CH3COOH CH3COO- + H+
CH3COO- + H+ 
или синильной кислоты:
HCN H+ + CN-
H+ + CN- 
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов, чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее. Так, например, поскольку КHCN =6,2×10-10<KCH3COOH = 1,8×10-5, то синильная кислота хуже диссоциирует и слабее, чем уксусная кислота.
Многоосновные кислоты диссоциируют ступенчато:
H3PO4 H+ + H2PO4-
H+ + H2PO4- 
H2PO4- H+ + HPO42-
H+ + HPO42- 
HPO42- H+ + PO43-
H+ + PO43- 
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
H3PO4 3H+ + PO43-
3H+ + PO43- 
Закон разбавления Оствальда. При диссоциации слабого электролита, например, CH3COOH, молярная концентрация которого равна С, начальные и равновесные концентрации молекул и ионов равны:
CH3COOH CH3COO- + H+
CH3COO- + H+
Снач С 0 0
Сравн С-Ca Ca Ca
где a - степень диссоциации.

Поскольку для слабых электролитов a<<1 и 1 - a» 1, имеем K=C×a2 или a =  .
.
Закон разбавления Оствальда: степень диссоциации слабого электролита увеличивается при уменьшении его концентрации, то есть при разбавлении.
Влияние общего иона на диссоциацию слабого электролита. Добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
CH3COOH  CH3COO- + H+ a<<1
CH3COO- + H+ a<<1
сильного электролита, содержащего общий с CH3COOH ион, то есть ацетат-ион, например, CH3COONa
CH3COONa  CH3COO- + Na+ a = 1
CH3COO- + Na+ a = 1
концентрация ацетат иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, то есть диссоциация уменьшается.
|
|
|
Пример. Найти [H+] в 0,1 М растворе CH3COOH K=1,8×10-5.
Решение. Для CH3COOH  CH3COO- + H+
CH3COO- + H+
имеем  Поскольку CH3COOH - слабый электролит, то [CH3COOH] = С = 0,1 М, кроме того [H+] = [CH3COO-]. Отсюда
Поскольку CH3COOH - слабый электролит, то [CH3COOH] = С = 0,1 М, кроме того [H+] = [CH3COO-]. Отсюда  .
.
Пример. Найти [H+] в растворе 0,1 М CH3COOH (K=1,8×10-5) и 0,1 М CH3COONa (a=1).
Решение. Имеем CH3COOH  CH3COO- + H+ (a<<1)
CH3COO- + H+ (a<<1)


и CH3COONa CH3COO- + Na+ a = 1
CH3COO- + Na+ a = 1
Учитывая, что CH3COOH - слабый электролит и пренебрегая числом диссоциированных молекул, полагаем
[CH3COOH] = C(CH3COOH)=0,1 М. Поскольку CH3COONa диссоциирован полностью и пренебрегая количеством ионов CH3COO-, образовавшихся при диссоциации CH3COOH, получаем
[CH3COO-]=C(CH3COONa)=0,1 М. Отсюда имеем: 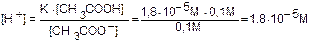 .
.
Видно, что при добавлении раствора CH3COONa к раствору CH3COOH концентрация ионов водорода уменьшилась в 1,34×10-3 / 1,8×10-5 = 74,4 раза.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 418; Нарушение авторских прав?; Мы поможем в написании вашей работы!