
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия идеального газа (свойства и расчет)
|
|
|
|
Из определения идеального газа следует, что внутренняя энергия (определение см. в лекции 1) идеального газа является просто кинетической энергией хаотического поступательного движения молекул газа. Потенциальная энергия взаимного расположения молекул в геометрическом пространстве, вращательная и колебательная энергия молекул идеального газа пренебрежимо малы по сравнению с кинетической энергией поступательного движения. Именно это обстоятельство позволило Больцману корректно провести усреднение кинетической энергии по множеству всех молекул и получить знаменитую формулу, известную из курса физики:
u = 3/2 kT, (2.18)
где k – постоянная Больцмана, Т – термодинамическая температура, u – средняя по множеству всех молекул кинетическая энергия.
Выражение (2.18) по существу показывает, что внутренняя энергия идеального газа является функцией только температуры и что изменение внутренней энергии Δu определяется только изменением температуры:
(∂u/∂(∙))T = 0
Здесь вместо точки в выражении частной производной можно подставить любой параметр состояния (конечно, кроме Т).
Отсюда сразу следует, что для идеального газа (см.(2.13) и (2.14)) расчет изменения внутренней энергии и энтальпии существенно упрощается, т.к. (∂u/∂v)T = 0 и (∂h/∂p) = 0 и
du = cvdT и dh = cpdT → Δu =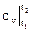 (t2 – t1); Δh =
(t2 – t1); Δh =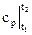 (t2 – t1); (2.19)
(t2 – t1); (2.19)
И такой способ расчета изменений функций состояния справедлив для любых процессов с идеальным газом.
Можно также предложить другой способ расчета изменения функций состояния, если имеется в наличии диаграмма p – v или T – s для какого-то вещества в идеальном состоянии. Например, рассмотрим диаграмму T – s и процесс 1 – 2 на рис. 2.7.
|
|
|

Рис 2.7. Графический способ расчета изменения
внутренней энергии и энтальпии для идеального газа в процессе 1 – 2.
Точки 1 и 2 характеризуют два состояния с температурами Т1 и Т2 (на рис 2.7 показаны две соответствующие изотермы). Изменение энтальпии Δh определяется (см.(2.5)):
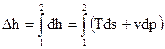 , (2.20)
, (2.20)
и для функций состояния Δh не зависит от траектории процесса, а зависит только от температуры в начальном и конечном состоянии (изотермы Т1 и Т2). Глядя на (2.20), видно, что по диаграмме T – s нельзя найти определенный интеграл от vdp. Тогда расчет Δh будем вести не по реальной кривой 1 -2 на рис 3.1, а по изобаре p = const (dp = 0 и vdp = 0) и второй интеграл станет нулевым.
Строим изобару p = const на диаграмме, тогда площадь под изобарой в нужном температурном интервале Т1 и Т2 и будет численно равна изменению энтальпии Δh.
Аналогично,
 (2.21)
(2.21)
Строим изохору v = const, и площадь под ней в тех же температурных пределах будет численно равна изменению внутренней энергии в процессе 1 – 2.
Замечание. Расположение изохоры или изобары на плоскости с координатами T – s правее или левее относительно процесса 1 – 2 здесь не существенно: площадь под кривыми неизменна.
Также просто найти изменение функций состояния в любом процессе с идеальным газом, если он изображен на диаграмме с координатами p – v. Предлагаем студентам самим проделать эту процедуру в качестве тренировки.
Замечание. Такая простота и легкость расчета изменения функций состояния в любом процессе обусловлена двумя обстоятельствами:
1. Зависимостью внутренней энергии идеального газа только от температуры.
2. Независимостью приращения функций состояния от траектории процесса, а, следовательно, возможностью выбора удобной для интегрирования траектории в интервале лишь температур начала и конца процесса.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 594; Нарушение авторских прав?; Мы поможем в написании вашей работы!