
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакції Al3+-іонів
|
|
|
|
Якісні реакції катіонів ІV аналітичної групи
ЯКІСНІ РЕАКЦІЇ КАТІОНІВ ІV-VІ АНАЛІТИЧНИХ ГРУП
План
3.1 Якісні реакції катіонів ІV аналітичної групи.
3.2 Систематичний аналіз суміші катіонів IV аналітичної групи.
3.3 Якісні реакції на катіони V аналітичної групи.
3.4 Систематичний аналіз суміші Fe2+, Fe3+, Mn2+, Mg2+-іонів.
3.5 Якісні реакції на катіони VI аналітичної групи.
3.6 Систематичний аналіз суміші Cu2+, Hg2+, Ni2+, Co2+, Cd2+-іонів.
3.7Систематичний хід аналізу суміші катіонів IV-VI аналітичних груп.
3.8 Систематичний аналіз суміші катіонів шести аналітичних груп.
До четвертої аналітичної групи належать йони Al3+, Cr3+, Zn2+, Sn2+, Sn (IV)
As3+, As(V). Груповим реактивом на йони IV аналітичної групи є NaOH, який осаджує всі перелічені йони у вигляді гідроксидів з вираженими амфотерними властивостям, тобто розчинних у кислотах і надлишку лугу.
36. Реакція з амоній гідроксидом. Водний розчин амоній гідроксиду осаджує з розчинів солей Алюмінію білий амфотерний осад алюміній гідроксиду: Al3+ + 3NH3×H2O ® Al(OH)3¯ + 3NH4+
Осад розчиняється у кислотах і лугах:
Al(OH)3 + 3H+ ® Al3+ + 3H2O
Al(OH)3 + OH- ® [Al(OH)4]-
Виконання реакції. У пробірку додають 3-4 краплі розчину солі Алюмінію і 5-6 крапель розчину амоній гідроксиду з СН = 6,0, суміш нагрівають суміш. Випадає білий осад. До однієї частини осаду додають розчин хлоридної кислоти до іншої – розчин лугу. Спостерігають розчинення осаду в обох випадках.
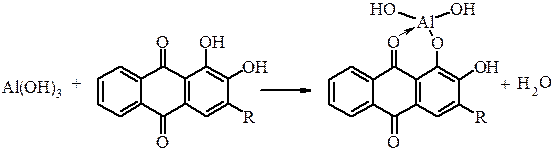 |
37. Реакція з алізарином. Алізарин з Al3+-йонами утворює комплексну сполуку Al(OH)2[C14O3H6(OH)] червоного кольору, яка не розчиняється в оцтовій кислоті. Ця сполука називається “алюмінієвим лаком”. Алізарин малорозчинний у воді, тому на практиці використовують алізариновий червоний – натрієву сіль 1,2-діоксіантрахінон-3 сульфокислоти (де R= -SO3Na):
|
|
|
Заважають: Fe2+, Cu2+, Bi3+-йони (також утворюють забарвлені осади).
Виконання реакції. До 3-5 крапель розчину, що аналізують, добавляють розчин NaOH з СН=2,0 до сильнолужної реакції. Якщо випадає осад (присутні Fe2+, Cu2+, Bi3+-іони), його відокремлюють центрифугуванням і до прозорого розчину додають 2-4 краплі 0,2 %-ного розчину алізарину (з’являється фіолетове забарвлення), потім добавляють краплями розчин CH3COOH з СН = 2 поки не зникне фіолетове забарвлення. При наявності алюмінію (залежно від його концентрації) розчин забарвлюється в червоний колір або випадає червоний осад.
Цю реакцію можна виконувати краплинним методом. Для цього на смужку фільтрувального паперу наносять 1 краплю розчину K4[Fe(CN)6] і в центрі утвореної плями вміщують 1 краплю досліджуваного розчину. При цьому усі катіони ІІІ і IV аналітичних груп, крім Al3+, осаджуються у вигляді гексаціанофератів і залишаються в центрі плями, тоді як Al3+-йони по капілярах переміщуються на периферію плями. Після цього обробляють пляму амоніаком (тримають папір над отвором склянки з концентрованим розчином амоніаку) і змочують зовнішню зону плями розчином алізарину. Потім знову обробляють пляму газоподібним амоніаком. Після цього папір висушують і зовнішню зону плями змочують розчином СН3СООН з СН=1,0. За наявності Al3+-іонів з’являється рожеве кільце (рисунок 3.1).
38. Реакція з кобальт(ІІ) нітратом. Кобальт нітрат при прожарюванні з солями Алюмінію утворює кобальт алюмінат синього кольору, який називають «тенаровою синню»:
2Al2(SO4)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 4NO2↑+O2↑+6SO3
Виконання реакції. У фарфорову чашку вносять 3-4 краплі розчину солі Алюмінію, додають таку саму кількість розчину кобальт нітрату. Суміш випаровують і прожарюють до виділення газів. Спостерігають утворення кобальт алюмінату синього кольору.
Заважають: Zn2+-йони, утворюючи зелену сполуку.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3359; Нарушение авторских прав?; Мы поможем в написании вашей работы!