
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометрія
|
|
|
|
Кондуктометричний метод аналізу заснований на вимірюванні електропровідності аналізованого розчину.
Електроліти у водному розчині дисоціюють на йони. Електричний струм переноситься тільки тією частиною речовини, яка дисоційована на йони. Електричний струм, що проходить через розчин електроліту, направляє позитивно заряджені йони до катоду (негативно зарядженого електроду) і негативно заряджені йони до аноду (позитивно зарядженого електроду). Отже, всі заряджені частинки вносять свій внесок в електропровідність. Електропровідністю називають величину, зворотну електричному опору R.
Одиницею виміру електропровідності є Ом-1. Електропровідність залежить від температури, тому під час дослідів підтримують постійну температуру. Розчини електролітів – провідники II роду – підкоряються закону Ома. За аналогією з опором провідників I роду, опір розчину прямо пропорційно відстані між електродами l і обернено пропорційно площі їх поверхні S:
R = r (l / S), (11.1)
де r – питомий опір (Ом×см). При l = 1см і S = 1см2 маємо R = r, отже, питомий опір дорівнює опору 1 см3 розчину, що знаходиться між двома паралельними пластинами площею 1 см2, які віддалені одна від одної на 1 см.
Розчин – тривимірний провідник. Величина опору будь-якого розчину залежить від геометрії осередку, в якому проводиться вимір, а саме: А–площі поперечного перерізу (в см2) двох однакових електродів, віддалених один від одного на відстані b (см). Відношення b /A називають постійною чарунки (Q). На практиці труднощі розрахунку постійної (b/A) долається виміром стандартного розчину з відомою електропровідністю, наприклад, розчину KCl (дані в довідниках).
Величину, зворотну питомому опору, називають питомою електропровідністю c=1/r. Питома електропровідність (Ом-1×см-1) чисельно дорівнює струму (в амперах), що проходить через шар розчину з поперечним перерізом, рівним одиниці, під дією градієнта потенціалу 1 В на одиницю довжини.
|
|
|
Питома електропровідність сильних електролітів залежить від їх концентрації. У розведених розчинах сильних електролітів питома електропровідність підвищується зі збільшенням концентрації. У концентрованих розчинах сильних електролітів існує складна залежність між концентрацією електроліту і його питомою електропровідністю, тому що має місце взаємний вплив йонів. У розчинах слабких електролітів питома електропровідність пропорційна концентрації йонів в розчині, так як йонів мало і не враховується їх вплив. З урахуванням усіх цих факторів електропровідні властивості йонів характеризують еквівалентною йонною електричною провідністю (рухливістю).
Еквівалентною електричною провідністю (l) називають провідність розчину, який містить 1 моль еквіваленту речовини і перебуває між двома паралельними електродами, відстань між якими 1 см. Її одиницею вимірювання є Ом-1×см2×моль-1.
Зі зменшенням концентрації (зі збільшенням розведення) еквівалентна електропровідність збільшується і прагне до деякого граничного значення l¥, яке називається еквівалентною електропровідністю при нескінченному розведенні. Підвищення еквівалентної електропровідності зі зменшенням концентрації для сильних електролітів пояснюється зменшенням ефекту гальмування, а для слабких електролітів – збільшенням ступеня дисоціації. При нескінченно малій концентрації всі молекули розчиненої речовини розпалися на йони і подальше розведення не змінить загальної кількості йонів. Тому при нескінченно малій концентрації еквівалентна електропровідність досягає свого максимального значення (l0).
|
|
|
При нескінченно великому розведенні ступінь дисоціації a=1 і еквівалентна електропровідність прагне до найбільшого значення. У цьому випадку гранична еквівалентна електропровідність дорівнює сумі електропровідностей йонів при нескінченному розведенні: l0 =l0+ + l0–.
Питома і еквівалентна провідність пов'язані співвідношенням:
l = 1000 c / с, (11.2)
де с – молярна концентрація еквіваленту, моль-екв/л;
c – питома електропровідність, Ом-1×см-1.
Еквівалентні електропровідності (рухливості) деяких йонів наведені в таблиці 11.1.
Вимірювання електричної провідності розчинів широко застосовують в титриметричному аналізі для визначення точки еквівалентності (кондуктометричне титрування). У методах кондуктометричного титрування вимірюють електричну провідність розчину після додавання невеликих певних порцій титранту і знаходять точку еквівалентності графічним методом за допомогою кривої в координатах c– V титранта. Практично в цьому методі можуть бути використані такі хімічні реакції, в ході яких відбувається різка зміна (зазвичай зростання) електричної провідності після точки еквівалентності (реакції кислотно-основної взаємодії, осадження, комплексоутворення і т. д.).
Таблиця 11.1 – Граничні еквівалентні електропровідності йонів у водних розчинах при нескінченному розведенні при 250С
| Катіони | l0+, Ом-1×см2×моль-1 | Аніони | l0–, Ом-1 ×см ×моль-1 |
| H+ (H3O +) | 349,8 | OH- | 198,0 |
| K+ | 73,5 | Cl- | 76,3 |
| Na+ | 50,1 | CH3COO- | 40,9 |
Наприклад, при титруванні розчину сильної кислоти HCl розчином лугу NaOH електропровідність розчину спочатку зменшується, тому що концентрація йонів водню зменшується при реакції з гідроксид-іоном з утворенням води: H+ + OH–= H2O.
Сумарна кількість йонів зберігається, тому що йони водню еквівалентно замінюються йіонами лужного металу Na+. У момент повної нейтралізації електропровідність досягає мінімуму. При подальшому додаванні лугу після точки еквівалентності має місце збільшення електропровідності, так як в розчині з'являється надлишок йонів OH– з великою рухливістю.
Електропровідність розчину вимірюють після додавання кожної порції титранту. За результатами титрування будують криву титрування. Хід кривої титрування представлений на (рисунок 11.5).
|
|
|
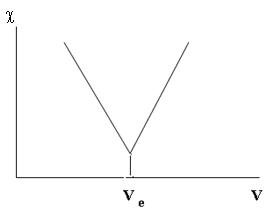
Рисунок 11.5 – Крива кондуктометричного титрування розчину HCl
розчином NaOH
Еквівалентний об'єм лугу визначається на перетині двох прямих ділянок кривої титрування. У еквівалентній точці знаходяться тільки йони Na+ і Cl–. Цей розчин має найменшу електропровідність і найбільший опір. Знаючи точну концентрацію титранту, його обсяг, який пішов на титрування, і обсяг кислоти, взятий для титрування, можна обчислити концентрацію кислоти, яку титрували: C (HCl) = C (NaOH) ×Vе (NaOH) / V (HCl)
Кондуктометричне титрування застосовується для титрування забарвлених або каламутних розчинів, коли неможливо використовувати індикатори; сумішей сильних і слабких кислот; сумішей слабких і сильних основ; розчинів солей.
 |
Для кондуктометричного титрування застосовують кондуктометри (рисунок 11.6).
Рисунок 11.6 – Кондуктометр промисловий BL
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1056; Нарушение авторских прав?; Мы поможем в написании вашей работы!