
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критерий самопроизвольного протекания процессов
|
|
|
|
При постоянных температуре и давлении, как уже говорилось выше, из соотношения (1.20) следует:
DG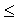 –Aпол . (1.23)
–Aпол . (1.23)
При отсутствии полезной работы получаем:
DG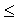 0. (1.24)
0. (1.24)
Из этого соотношения следует, что при протекании обратимых химических реакций энергия Гиббса неизменна (DG=0), а при протекании реальных, самопроизвольных процессов она уменьшается. Иными словами, получаем общий критерий (при постоянных температуре и давлении) самопроизвольного протекания процесса: при P=const, T=const самопроизвольно протекают только процессы, сопровождающиеся уменьшением энергии Гиббса. Пределом протекания процесса будет состояние с минимальным при данных условиях значением энергии Гиббса. После достижения минимума энергия Гиббса перестает изменяться и DG=0, система находится в состоянии равновесия. Например, взрыв смеси водорода и кислорода –
H2 (г) +  O2 (г) = H2O (ж);
O2 (г) = H2O (ж);  =–237 кДж
=–237 кДж
– самопроизвольный процесс: достаточно внести в эту смесь спичку или катализатор и мгновенно начинается реакция. Обратный процесс – разложение воды при 298,15 К на водород и кислород – имеет значение энергии Гиббса 237 кДж/моль. Это несамопроизвольный процесс, для его реализации необходимо привлечение работы извне, например, работы электрического тока. Таким образом, приходим к выводу, что критерием невозможности самопроизвольного протекания процесса будет положительное значение энергии Гиббса этого процесса.
Подчеркнем, что высказанный критерий самопроизвольного протекания процесса имеет принципиальный характер, он является необходимым условием для самопроизвольного протекания процесса. Достаточные же условия составляют область химической кинетики. Сказанное можно иллюстрировать следующей схемой:
|
|
|
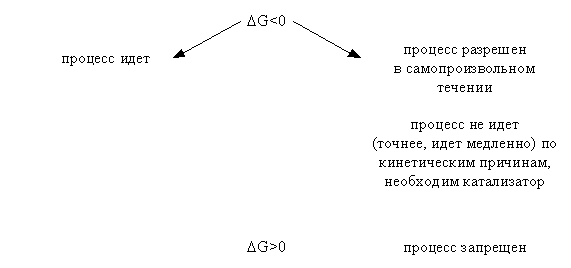
Из соотношения (1.21) следует, что
DG = DH – TDS. (1.25)
Поэтому при анализе вопроса о возможности самопроизвольного протекания процесса необходимо рассматривать два вклада (DH и TDS) или, как говорят, энтальпийный и энтропийный факторы. Самопроизвольное течение процесса возможно при:
| DH<0 и DS>0 | DH > 0 и DS > 0, если TDS > DH |
| DH < 0 и DS < 0, если |DH| > |TDS| |
Энергия Гиббса является мерой химического сродства, чем отрицательнее DG химической реакции, тем проще, в более мягких условиях идет процесс.
В интервалах температур порядка сотен Кельвинов температурная зависимость величин DH и DS невелика и ею можно пренебречь. Иными словами, точное соотношение DGT=DHT–TDST заменяется приближенным
DGT»DH298–TDS298. (1.26)
Это выражение позволяет оценивать значения энергии Гиббса при температурах, отличных от 298,15 К. Например, необходимо оценить условия, при которых самопроизвольно протекает реакция:
СаСО3 (к) = СаO (к) + СO2 (г).
Характеристики этой реакции при 298,15 К:
DG0298=DG0обр.CO2 (г)+ DG0обр.CaO (к)–DG0обр.CaCO3 (к) =130,6 кДж;
DH0298=DH0обр.CO2 (г)+ DH0обр.CaO (к)–DH0обр.CaCO3 (к) =178,4 кДж;
S0298=S0CO2 (г) + S0CaO (к)–S0CaCO3 (к) = 160,5 Дж/К.
При 298,15 К данная реакция самопроизвольно не протекает ( ), энтальпия и энтропия реакции также положительны. А это означает, что
), энтальпия и энтропия реакции также положительны. А это означает, что
с ростом температуры отрицательный энтропийный вклад будет расти и после достижения определенной температуры превысит положительный энтальпийный вклад. Границей перехода от запрещенного процесса к самопроизвольному протеканию является DGT=0.
Тогда, согласно соотношению (1.25) получаем:
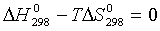 ;
;

Таким образом, при температурах выше 8390С разложение карбоната кальция станет самопроизвольным процессом.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5539; Нарушение авторских прав?; Мы поможем в написании вашей работы!