
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование растворов, растворимость. Пример 1. Пользуясь справочными данными, определить давление паров над водой при 298,15 К
Задачи и упражнения
Пример 1. Пользуясь справочными данными, определить давление паров над водой при 298,15 К.
Решение. Равновесие испарения воды
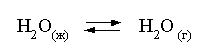
описывается соответствующей константой, численно равной давлению водяных паров (концентрация жидкой воды постоянна и равна 1!):
Kравн = PH2O.
Находим величину DG0 указанного процесса:
DG0 = DG0обр H2O(г) – DG0 обр H2O(ж) = –228,6 – (–237,3) = 8,7 кДж.
Вычисляем давление паров воды:
DG0 = – RTlnKравн = –RTlnPH2O;
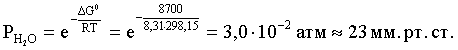
Пример 2. Пользуясь справочными данными, определить растворимость йода в воде при 298,15 К.
Решение. Для равновесия
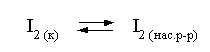
константа равновесия равна:
Kравн = 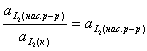 .
.
Определим DG0 для указанного процесса:
DG0 = DG0обр I2 (р-р, ст.с) – DG0 обр I2 (к) = DG0 обр I2 (р-р, ст.с) = 16 кДж.
Далее:
DG0 = – RTlnKравн = –RTln a I2 (нас.р-р) = DG0 обр I2 (р-р, ст.с)

Как видно, растворимость йода в воде мала, поэтому активность можно уверенно считать равной концентрации (коэффициент активности равен единице). Таким образом, растворимость йода в воде при 298,15 К составляет 1,6·10-3 моль/л или 0,40 г/л.
Пример 3. 44,8 л (н.у.) хлороводорода растворили в 300 мл воды. Определить моляльность полученного раствора и массовую долю НСl
в нем.
Решение. 44,8 л (н.у.) хлороводорода составляют 2 моль и имеют массу 2·36,5 = 73,0 г. Масса полученного раствора составляет (плотность воды 1,00 г/мл): 300 · 1 + 73,0 = 373,0 г.
Определяем массовую долю хлороводорода в растворе:
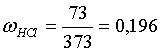 .
.
Наконец, находим моляльность полученного раствора:
2 моль НСl – 0,30 кг Н2О
Х – 1,00 кг,
откуда Х = mр-ра = 6,67 моль/кг.
Пример 4. Какой объем 3,00 мас.% раствора NaCl (плотность раствора 1,020 г/мл) и 12,00 мас.% раствора NaCl (плотность раствора 1,086 г/мл) необходимо смешать для приготовления 400 мл 7,50 мас.% раствора этого соединения с плотностью 1,053 г/мл?
Решение. Задача сводится к составлению двух материальных балансов – масса приготовляемого раствора равна сумме масс составляющих его растворов и масса растворенного вещества в приготовляемом растворе равна сумме масс этого вещества в двух исходных растворах. Необходимо помнить, что для объемов растворов это правило не выполняется! Пусть необходимый объем 3,00 мас.% раствора составляет Х мл, а объем 12,00 мас.% раствора – Y мл.
Первое уравнение:
1,020×X + 1,086×Y = 400×1,053 = 421,2;
второе уравнение:
0,03×1,020X + 0,12×1,086Y = 0,075×421,2 = 31,6
Решение этой системы уравнений приводит к результату: Х = 205,4 мл, Y= 194,8мл.
Пример 5. Сколько граммов кристаллогидрата Na2SO4×10H2O и мл воды необходимо для приготовления 400 мл 15 мас.% раствора Na2SO4 с плотностью 1,142 г/мл. Определить молярность, моляльность, титр приготовленного раствора, а также мольную долю Na2SO4 в растворе.
Решение. Определим содержание Na2SO4 в приготовляемом растворе:
mNa2SO4 = mр-ра × 0,15 = 400 × 1,142 × 0,15 = 68,5 г.
Молярная масса Na2SO4 составляет 142 г/моль, a Na2SO4×10H2O – 322 г/моль. Соответственно, 68,5 г Na2SO4 содержатся в 68,5×322/142 = 155,3 г кристаллогидрата. Наконец, находим массу (объем) воды, необходимой для приготовления раствора:
mH2O = VH2O = m р-ра – m кр-та = 400 × 1,142 – 155,3 = 301,5 г или 301,5 мл.
Теперь решаем отдельную задачу о нахождении молярности, моляльности, титра и мольной доли соли в 15 мас.% растворе Na2SO4. Поскольку
в определении молярности и титра задействованы литр и миллилитр, целесообразно отталкиваться от объема раствора, равного 1 л. Итак пусть имеется 1 л 15 мас.% раствора Na2SO4 с плотностью 1,142 г/мл. Находим массу растворенной в нем соли и переводим в моли:
mNa2SO4 в 1 л р-ра = 1000 × 1,142 × 0,15 = 171,3 г
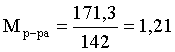
Тут же легко находится титр: Т = 171,3 / 1000 = 0,1713.
Теперь определим массу воды в 1 л раствора:
mH2O = 1142 - 171,3 = 970,7 г
и вычисляем моляльность:
 .
.
В 1 л раствора находится 1,21 моль соли и 970,7/18 = 53,9 моль воды, отсюда мольная доля соли составляет:
мольная доля 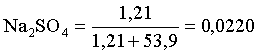 .
.

Пример 6. Сколько мл 20 мас.% раствора NaOH необходимо прилить к 500 мл 5 мас.% раствора того же соединения для получения 2М раствора NaOH. Плотности растворов равны соответственно 1,219; 1,054 и 1,080 г/мл.
Решение. Решение задачи сводится к нахождению числа молей NaOH в приготовляемом растворе и его объема (в литрах).
Пусть необходимо прилить Х мл 20 мас.% раствора. Определим число молей (количество вещества) NaOH в двух сливаемых растворах:
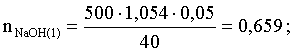

Объем окончательного раствора находим через его массу и плотность:
mр-ра = mр-ра(1) + mр-ра(2) = 500×1,054 + Х×1,219 = 527 + 1,219Х
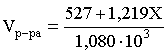
Согласно условию, число молей NaOH, отнесенное к объему раствора в литрах, равняется двум:

Решение этого уравнения и дает ответ – необходимо прилить 82,5 мл
20 мас.% раствора.
Пример 7. Раствор имеет мольное отношение NaOH: H2O = 1: 100. Определить концентрацию этого раствора в мас.% и его моляльность.
Решение. Раствор содержит 1 моль NaOH и 100 моль Н2O, что составляет 40 г и 100×18 = 1800 г соответственно. Находим моляльность:
1 моль NaOH – 1,8 кг Н2О
Х – 1 кг Н2О, откуда Х = m = 0,556.
Масса раствора составляет 40 + 1800 = 1840 г, а его концентрация
 мас.%.
мас.%.
|
|
Дата добавления: 2014-01-04; Просмотров: 1119; Нарушение авторских прав?; Мы поможем в написании вашей работы!