
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменился ли подход к проблеме устойчивости дисперсных систем на современном этапе развития коллоидной химии?
Н.П. Песковым в 1920 г было предложено различать кинетическую и агрегативную устойчивости. В первом случае рассматривается выделение диспергированной фазы под действием силы тяжести в зависимости от степени дисперсности, а сама степень дисперсности полагается величиной, постоянной для данной системы. Во втором случае рассматриваются условия постоянства или непостоянства самой степени дисперсности частиц.
Вы уже, наверное, усвоили, что в дисперсных системах удельная поверхность дисперсной фазы очень велика. Одно из наиболее важных следствий большой поверхности дисперсной фазы заключается в том, что лиофобные дисперсные системы обладают избыточной поверхностной энергией, а, следовательно, являются термодинамически неустойчивыми. Поэтому в дисперсных системах протекают различные самопроизвольные процессы, которые ведут к уменьшению избытка энергии. Наиболее общими являются процессы уменьшения удельной поверхности за счет укрупнения частиц. В итоге такие процессы приводят к разрушению системы. (Подумайте, какой еще процесс может привести к уменьшению поверхностной энергии?) Таким образом, ключевое свойство, которое характеризует само существование дисперсных систем – это их устойчивость, или, наоборот, неустойчивость.
Вы уже знаете, что благодаря существованию ДЭС частицы дисперсной фазы приобретают определенные свойства. Первое из них, как уже упоминалось выше, заключается в повышении устойчивости дисперсных систем. Дайте характеристику второй группе свойств, которые связаны с электрокинетическими явлениями.
Наиболее важным электрокинетическим явлением, которое типично для дисперсных систем, является электрофорез, т. е. перемещение коллоидных частиц во внешнем электрическом поле. (Вспомните, а как называется перемещение дисперсионной среды относительно дисперсной фазы во внешнем электрическом поле?)
Электрофорез и электроосмос – это электрокинетические явления I-го рода. К электрокинетическим явлениям II-го рода относятся потенциал протекания и потенциал седиментации, которые заключаются в возникновении разности потенциалов при перемещении частиц дисперсной фазы или дисперсионной среды.
Величина ζ -потенциала связана со скоростью электрофореза заряженных частиц уравнением Гельмгольца-Смолуховского:
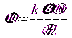
где k – коэффициент, зависящий от формы частиц (для сфер k = 6, для цилиндров k = 4); v – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость; E – напряженность электрического поля.
Линейная скорость v изменяется пропорционально напряженности поля E, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности:
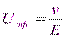 ;
; 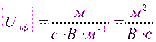 .
.
Величина Uэф не зависит от приложенного напряжения.
В SI значение ζ -потенциала вычисляется по формуле:
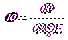
Электрофоретическая подвижность различных частиц имеет величины порядка: для золей Uэф = (0,4÷0,8)∙10-8 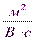 , для эритроцитов животных Uэф = (1,0÷1,7)∙10-8
, для эритроцитов животных Uэф = (1,0÷1,7)∙10-8 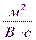 . Экспериментально найденные значения электрофоретических подвижностей часто оказываются меньше расчетных. Здесь следует иметь в виду, что как единое целое перемещается не мицелла, а коллоидная частица. Поэтому на подвижность влияют два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя ионов вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны. Описанная ситуация подобна той, когда лодка перемещается не в стоячей воде, а против течения воды.
. Экспериментально найденные значения электрофоретических подвижностей часто оказываются меньше расчетных. Здесь следует иметь в виду, что как единое целое перемещается не мицелла, а коллоидная частица. Поэтому на подвижность влияют два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя ионов вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны. Описанная ситуация подобна той, когда лодка перемещается не в стоячей воде, а против течения воды.
Методы электрофореза имеют большое теоретическое и практическое значение. Величина ζ -потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение устойчивости, как правило, происходит симбатно с изменением электрокинетического потенциала. В настоящее время электрофорез является мощным средством для изучения фракционного состава сложных биологических систем – природных белков (метод Тизелиуса), а также используется для получения характеристики таких природных объектов, как энзимы, вирусы, бактерии, форменные элементы крови и др. С помощью электрофореза можно выделять из суспензий взвешенные частицы, а также производить покрытие твердых частиц или поверхностей слоем других веществ. Электрофорез применяют для очистки различных фармацевтических препаратов. В Фармакопеях (сборниках стандартов и положений, регламентирующих требования к качеству лекарственных средств) предусмотрено установление степени чистоты по электрофоретической однородности ряда антибиотиков, витаминов и других препаратов. (Какие еще области применения электрофореза Вы можете указать?)
^ Вопросы и задания для самоконтроля знаний по материалу 13-й лекции
1.
Какие теории строения двойного электрического слоя Вы знаете? Составьте таблицу, в которой укажите достоинства и недостатки каждой из теорий.
2.
Какие основные характеристики используются для оценки электрических свойств дисперсных систем?
3.
Чему равен потенциал поля, образованного точечным зарядом и сферой?
4.
Опишите современную модель строения мицеллы.
5.
Что называют поверхностным и электрокинетическим потенциалами? В чем их различия?
6.
Какие факторы влияют на ДЭС и значения потенциалов?
7.
Возможно ли изменение знака заряда коллоидной частицы без изменения φo -потенциала?
8.
Почему экспериментально найденные и теоретически рассчитанные значения электрофоретической подвижности не совпадают?
9.
Где применяют методы электрофореза?
10.
Объясните механизм электроосмоса, основываясь на Вашем знании строения мицелл частиц золей.
11.
Где применяют метод электроосмоса?
Знакомимся с основными понятиями физической химии (для курсантов военного факультета)
Повторяем курс физической химии (для студентов химического факультета)
1.
...............
ЛЕКЦИЯ 14
«Характерное отличие коллоидных систем от истинных растворов заключается в том, что степень дисперсности коллоидных частиц является величиной непостоянной. Укрупнение частиц постепенно приводит к тому, что они становятся слишком крупными и утрачивают те физические и химические особенности, которые присущи именно дисперсным частицам. Поэтому проблема устойчивости дисперсных систем является центральной в коллоидной химии. От ее решения зависят «жизнь и смерть» дисперсных систем»
Б.Д. Сумм
Б.Д. Сумм предлагает различать 4 вида неустойчивости коллоидных систем:
(Давайте вспомним: под устойчивостью лиофобных дисперсных систем понимается их способность сопротивляться протеканию процессов, ведущих к изменению их дисперсности, характера распределения частиц по размерам, а также в объеме дисперсионной среды.)
^ 1) Термодинамическая (агрегативная) неустойчивость проявляется в постепенном увеличении размеров дисперсных частиц или образования агрегатов из слипшихся частиц.
Эволюцию агрегативно неустойчивой дисперсной системы количественно характеризуют зависимостью размера частиц и их распределения по размерам от времени, а также временнóй зависимостью концентрации частиц. (Поясните, к чему в последнем случае ведет укрупнение частиц при неизменной общей массе дисперсной фазы.)
Избыточная поверхностная энергия As дисперсной системы описывается уравнением:
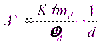 ,
,
где ^ K – коэффициент формы; σ – удельная поверхностная энергия; ρd – плотность вещества дисперсной фазы, md – масса дисперсной фазы.
Это уравнение (Поясните, как оно получается.) показывает, что возможны два разных процесса уменьшения поверхностной энергии дисперсной системы:
-Укрупнение дисперсных частиц, приводящее к увеличению их размера (σ = const). Этот процесс называют коалесценцией (слиянием). Он характерен для систем с жидкими или газообразными частицами.
-Уменьшение удельной поверхностной энергии (поверхностного натяжения, d = const). Соответствующий процесс называется коагуляцией. Он заключается в образовании агрегатов из многих дисперсных частиц, разделенных тонкими прослойками дисперсионной среды. Коагуляция характерна для систем с твердыми частицами.
^ 2) Седиментационная неустойчивость. Вызывается различием плотностей веществ дисперсной фазы и дисперсионной среды (ρo). Это различие приводит к постепенному оседанию (седиментации) более крупных частиц (если ρd > ρo) или их всплыванию (если ρd < ρo).
Размер дисперсных частиц влияет на агрегативную и седиментационную устойчивости противоположным образом. Чем выше степень дисперсности (меньше размер частиц), тем сильнее проявляется их агрегативная неустойчивость, однако растет их устойчивость по отношению к седиментации.
^ 3) Фазовая неустойчивость. Имеется в виду изменение структуры частиц при сохранении их размеров. Например, при синтезе коллоидных растворов металлов, оксидов и гидроксидов дисперсные частицы обычно аморфны, а со временем внутри частиц может происходить энергетически выгодный процесс кристаллизации.
^ 4) Поверхностная неустойчивость. Ее причины различны. Например, ПАВ с большой молекулярной массой (белки) медленно диффундируют из объема дисперсионной среды на поверхность частиц и со временем образуют адсорбционный слой. Другой возможный механизм – растворение вещества дисперсных частиц в дисперсионной среде. Оно обусловливает несколько процессов:
-изменение химического состава раствора вблизи поверхности частиц и изменение строения ДЭС;
-изменение микрорельефа твердой поверхности и, как следствие, изменение краевых углов смачивания.
Анализ причин и форм неустойчивости дисперсных систем приводит к следующему принципиальному заключению: неравновесность вызывает эволюцию дисперсных систем. Таким образом, характеристики дисперсных систем могут существенно изменяться во времени.
Основная проблема теории устойчивости дисперсных систем заключается в определении конкретных причин и механизма объединения отдельных дисперсных частиц в более крупные агрегаты и в выяснении факторов, которые препятствуют их агрегированию.
Теорию устойчивости гидрофобных золей детально разработали Б. Дерягин и Л. Ландау и независимо Э. Фервей и Т. Овербек (теория ДЛФО). (Вспомните, какие две силы в соответствии с основным упрощающим положением в теории ДЛФО действуют на твердые дисперсные частицы.) В зависимости от соотношения этих сил возможны два варианта поведения коллоидного раствора:
1) Если преобладает сила притяжения (| fd | >| fe |), то дисперсные частицы сближаются, между ними возникает контакт, и они объединяются в более крупный агрегат (коллоидный «димер»). Таким образом, в этом случае элементарный акт процесса коагуляции может состояться.
2) Если преобладает электростатическое отталкивание (| fd | <| fe |), то частицы могут не вступать в непосредственное соприкосновение, и коагуляция золя не происходит.
Таким образом, в качестве основного фактора термодинамической устойчивости дисперсной системы в теории ДЛФО принимают электростатическое (кулоновское) отталкивание дисперсных частиц.
Для расчета условий коагуляции вводятся дополнительные концепции:
1) Частицы имеют призматическую форму и разделены плоскопараллельным зазором шириной h (см. рис.).
2) Частицы перемещаются только в направлении, перпендикулярном зазору. Броуновское движение исключается.
Для расчета условий сопоставляются не силы притяжения, а соответствующие им энергии взаимодействия (Ud, Ue).
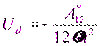
где 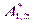 – сложная константа Гамакера; знак «–» указывает на взаимное притяжение.
– сложная константа Гамакера; знак «–» указывает на взаимное притяжение.
Энергия электростатического взаимодействия (Ue) создается вследствие перекрывания диффузных слоев противоионов в тонкой пленке раствора электролита в зазоре между частицами.
Ue, которая зависит от толщины пленки, создает в пленке дополнительное давление – расклинивающее давление (Π). Π – это термодинамический параметр тонкой жидкой пленки в пространстве между частицами:
 ,
,
где Wf – это работа, которую нужно затратить для увеличения поверхности тонкой пленки на единицу площади при постоянной температуре.
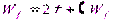 ,
,
где ΔWf – это дополнительная энергия пленки, которую нужно затратить для сближения поверхностных слоев ABB′A′ и CDD′C′. (Поясните коэффициент 2 в приведенном выражении.)

^ Рис. Возникновение расклинивающего давления в плоской тонкой пенной пленке с перекрыванием поверхностных слоев (h < 2δ)
По физическому смыслу величину Wf можно рассматривать как энергетическое определение поверхностного натяжения тонкой пленки.
Физический смысл величины Π – это избыточное давление в тонкой пленке по сравнению с гидростатическим давлением в большом объеме жидкости.
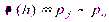 ,
,
где pf – давление в тонкой пленке.
Положительное расклинивающее давление препятствует утоньшению пленки!
Возникновение Π связано с поверхностными силами разной природы (электрическими, магнитными, молекулярными). Для коллоидной химии особенно важны первые и последние.
При толщине жидкой пленки 1 мкм Π может достигать 400 Па, а 0,04 мкм – 1,88∙104 Па.
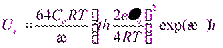 , (1)
, (1)
где 1/ æ = δ – толщина ионной атмосферы.
Не обязательно запоминать формулы! Главное уяснить, что Ue и Ud имеют разные знаки и по-разному зависят от толщины разделяющей пленки h:
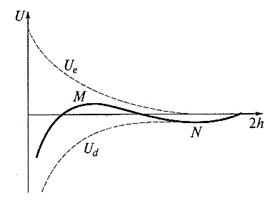
^ Рис. Изменение энергии (U) тонкой пленки электролита в зависимости от ее толщины (h)
Как видно из рисунка, Ue изменяется по экспоненциальному закону (пропорциональна e - æh ), Ud – по степенному (пропорциональна 1 /h2). Поэтому на малых расстояниях будет преобладать притяжение (при h → 0 Ud → ∞). На больших расстояниях также преобладает притяжение, т. к. степенная функция убывает медленнее, чем экспонента. На средних расстояниях возможен локальный (дальний) максимум. Он соответствует энергетическому (потенциальному) барьеру, который препятствует сближению частиц и их коагуляции.
Анализ уравнения и графика позволяет выделить три случая поведения дисперсной системы в зависимости от соотношения высоты энергетического барьера UM, глубины потенциальной ямы UN на больших расстояниях, и на малых расстояниях энергии тепловых колебаний kБT. (Проведите этот анализ!)
|
Дата добавления: 2014-01-04; Просмотров: 553; Нарушение авторских прав?; Мы поможем в написании вашей работы!