
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Группа веществ, изолируемых из биологического материала экстракцией и сорбцией
|
|
|
|
Этанола в крови человека
Данные о количественном содержании этанола в крови лежат в основе клинико-лабораторной диагностики степени опьянения. Установлена зависимость между содержанием этанола в крови и функциональным состоянием организма.
Критерии этой зависимости:
| Содержание этанола в крови, промилле | Степень опьянения | Признаки |
| Менее 0,3 | Отсутствие влияния аокоголя | |
| 0,3 - 0,5 | Незначительное влияние алкоголя | Вождение автотран-спорта запрещено |
| 0,5 -1,5 | Легкая степень опьянения | Легкое нарушение коор-динации движений |
| 1,5 – 2,5 | Опьянение средней степени | Возбуждение, иногда опасное для окружа-ющих, шатающаяся по-ходка, неясная речь, на-рушение психики и ориентировки, иногда резкая сонливость |
| 2,5 – 3,0 | Сильное опьянение | Ступор (оглушение), снижение болевой чув-ствительности до полной анестезии. Начальные признаки острого отравления. Возможен смертельный исход. |
| 3,0 – 5,0 | Тяжелое отравление алкоголем, возможно наступление смерти | Кома, опасное для жизни состояние. |
| Свыше 5,0 | Смертельное отравление |
Эта шкала имеет относительный характер, так как не всегда есть строгая корреляция между содержанием этанола в крови и функциональным состоянием организма. Степень и особенности функциональной реакции на прием алкоголя носят строго индивидуальный характер и зависят от многих факторов, таких, как:
-индивидуальная чувствительность организма,
-пол, возраст человека,
-состояние организма (болезнь, утомление и др.),
-форма, в которой принят алкоголь (водка, пиво и т.д.) и интервал между приемами,
-характер и количество принятой пищи и ряд других.
Даже у одного и того же лица одинаковые количества спирта, принятые в разное время при прочих равных условиях, могут вызвать различную функциональную реакцию и привести к разным степеням опьянения.
|
|
|
При судебно-химической оценке результатов определения этанола следует учитывать также падение количества алкоголя в крови за 1 час, составляющее 0,1- 0,15‰, поскольку между моментом происшествия и моментом смерти проходит обычно некоторый период времени, в течение которого протекают процессы метаболизма и выделения спирта из организма.
(подгруппа «Лекарственные средства»)
Номенклатура и классификация.
К группе веществ, изолируемых из биологического материала экстракцией и сорбцией (их еще называют «нелетучие» яды), относятся соединения кислотного, нейтрального и основного характера, различные по своему химическому строению. Номенклатура их очень велика и постоянно расширяется по мере синтеза новых соединений. Наибольшее токсикологическое значение в настоящее время имеют:
Вещества кислотного характера:
1) Органические кислоты: бензойная, салициловая, ацетилсалициловая, пикриновая.
2) Барбитураты: барбитал, фенобарбитал, барбамил, этаминал-Na, бутобарбитал, гексенал, бензонал, бензобамил, циклобарбитал и др.
Вещества нейтрального характера:
1) Небарбитуровые снотворные: ноксирон, тетридин.
2) Сердечные гликозиды.
3) Многоатомные фенолы: гидрохинон, пирогаллол.
4) Полинитропроизводные: м-динитробензол, динитротолуолы, тринитротолуол.
5) Производные анилина и п-аминофенола: фенацетин, п-фенилендиамин.
Вещества основного характера:
1) Алкалоиды: производные пиридина и пиперидина (жидкие алкалоиды), тропана (атропин, кокаин и др.), хинолина (хинин), изохинолина (опийные), индола (стрихнин, бруцин, резерпин), пурина (кофеин, теобромин, теофиллин), пирролизидина (платифиллин, саррацин), ациклические (эфедрин), стероидоподобные (вератрин) и неустановленного строения (аконитин).
|
|
|
2) Синтетические вещества основного характера: антипирин, амидопирин - производные пиразола, промедол - производное пиперидина, новокаин и дикаин - производные аминокислот ароматического ряда, изониазид, производные фенотиазина - аминазин и др., производные бензодиазепина и т.д.
При полном (общем, ненаправленном) судебно-химическом анализе обязательному исследованию в лабораториях БСМЭ подлежат, согласно Приказа МЗ СССР № 1021 от 25.12.73, следующие вещества:
Из веществ кислотного характера - производные барбитуровой кислоты.
Из веществ основного характера - алкалоиды: производные пиридина и пиперидина (никотин, пахикарпин), тропана, изохинолина (опийные алкалоиды), индола (стрихнин), производные фенотиазина, промедол.
Теоретические основы метода изолирования
Большинство «нелетучих» ядов, являясь слабыми кислотами или слабыми основаниями, способны существовать в водном растворе в виде ионизированных или неионизированных (молекулярных) форм в зависимости от рН среды. Степень ионизации вещества (слабой кислоты или слабого основания) и необходимое для этого значение рН могут быть определены из уравнения степени ионизации (уравнение Гендерсона):
a% = ------------------------- для кислот
1+ antilog (рКa - рН)
a% = ------------------------- для оснований
1+ antilog (рН - рКa)
где рКa - показатель ионизации вещества (-lgК), численно равный значению рН, при котором в растворе в равновесной концентрации присутствуют ионизированная и неионизированная (молекулярная) формы (т.е. вещество ионизировано на 50%). Эта величина постоянная для данного вещества.
Для большинства слабых кислот и слабых оснований рКa приведены в монографии Альберта и Сержента «Константы ионизации кислот и оснований». Сильные кислоты (HNO3 и др.) и сильные основания (NаОН) ионизированы на 100% в широком интервале рН.
На основании уравнения Гендерсона, зная рН раствора, всегда можно вычислить степень ионизации вещества и, наоборот, если необходимо достичь определенной степени ионизации, всегда можно рассчитать необходимое для этого значение рН.
Степень ионизации вещества всегда приходится учитывать при изолировании ядов из биологического материала, так как растворимость ионизированных и неионизированных форм различна в воде и органических растворителях.
|
|
|
Ионизированные формы, которым соответствуют соли кислот и оснований, как правило, хорошо растворимы в воде и ограниченно растворимы в неполярных органических растворителях (хлороформ и эфир).
Неионизированные (молекулярные) формы, которым соответствуют свободная кислота и основание, наоборот, хорошо растворимы в неполярных растворителях и ограниченно растворимы в воде.
Пользуясь различной растворимостью ионизированных и молекулярных форм «нелетучих» ядов в воде и органических растворителях легко сформулировать принцип их изолирования из биологического материала.
Изолирование «нелетучих» ядов из биологического материала основано на различной растворимости их ионизированной и молекулярной форм в воде и органических растворителях и на коэффициенте распределения молекулярной формы между водной и органической фазами.
С орг
Кр =-------------
С н2о
где Кр - коэффициент распределения молекулярной формы,
С - концентрации вещества в водной и органической фазах.
Очевидно, что, чем больше Кр, тем эффективнее идет экстракция.
В процессе изолирования «нелетучих» ядов из биологического материала взаимодействуют 3 компонента: яд, биологический материал и экстрагент.
При исследовании тканевого материала (внутренние органы трупа) изолирование состоит из двух стадий: извлечение яда из твердой фазы (объект) в водную и извлечение яда из водной фазы в органический растворитель.
Схематично это может быть представлено следующим образом:
I стадия экстракции II стадия экстракции
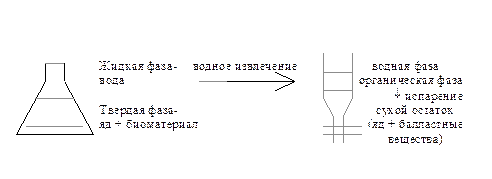
При исследовании биологических жидкостей (кровь, моча, промывные воды) необходимость в первой стадии изолирования отпадает и сразу проводится экстракция в органический растворитель.
Факторы, влияющие на эффективность изолирования «нелетучих» ядов из биоматериала.
Эффективность изолирования веществ на I и II стадиях определяется рядом факторов.
|
|
|
На первой стадии на эффективность изолирования вещества будут влиять такие факторы, как:
1) Растворимость яда в используемом экстрагенте.
Поскольку на первой стадии используются полярные растворители (вода), яд должен находиться в водорастворимом (ионизированном) состоянии, т.е. кислоты и основания должны присутствовать в виде своих солей, а степень ионизации a ® 100%.
Необходимое для этого значение рН может быть рассчитано из уравнения степени ионизации Гендерсона. На практике пользуются более простым правилом. Для того, чтобы полностью перевести вещество в ионизированное состояние (a ® 100%), необходимо создать
рН = рКa + 2(3) для кислот и
рН = рКa - 2(3) для оснований
Отсюда очевидно, что для переведения кислот в ионизированное состояние (т.е. в их соли) нужна щелочная реакция среды. Так, если для барбитуратов рКa =7-8,, то рН = рКa + 2(3) = (7-8)+2(3) = 10 и выше.
Для оснований же требуется кислая реакция среды. Так, для атропина рН = рКa - 2(3) = 9,6 - 3 = 6,6 и ниже.
Слабоосновные алкалоиды нацело ионизированы уже в сильно кислой среде, например, для кофеина рН» 2,0 (рКa» 0,6)
Кислая реакция среды (рН»2) приводит, кроме того, к разрушению комплексов алкалоидов с белками, в виде которых они находятся в биологическом материале, что увеличивает выход алкалоидов. Влияние рН на эффективность изолирования «нелетучих» ядов особенно выражено при использовании в качестве экстрагента воды, т.к. этанол в большинстве случаев является хорошим растворителем и для ионизированной, и для молекулярной форм кислот и оснований.
2) Экстрагент
Кроме реакции среды, на степень изолирования в значительной мере влияет природа экстрагента, его количество, время и кратность экстракции.
К экстрагенту предъявляются следующие основные требования:
-Способность легко проникать в клетки тканей.
-Высокая растворяющая способность (по отношению к яду).
-Селективность (по отношению к анализируемым соединениям). Селективный растворитель в какой-то мере исключает загрязнение вытяжки балластными веществами - жирами, белками, пигментами и другими.
В большей мере этим требованиям отвечает вода, несколько в меньшей степени - спирт, который является почти универсальным растворителем для лекарственных веществ. Основным недостатком этанола является способность экстрагировать совместно с анализируемыми веществами нормальные компоненты биоматериала (белки, жиры, пигменты), что усложняет анализ, приводя к дополнительным методам очистки и потерям значительных количеств искомых веществ.
Количество экстрагента обычно берется вдвое больше по отношению к весу органов (1:2). Большие количества экстрагента, хотя и увеличивают эффективность экстракции, приводят к разбавлению извлечения и усложнению последующих операций, связанных с концентрированием веществ в извлечении.
Время экстракции определяется моментом наступления равновесия в концентрациях вещества между твердой и жидкой фазами, что устанавливается экспериментально (по прекращению прироста концентрации вещества в экстрагенте). Для воды оно меньше (около 2 часов) по сравнению с этанолом (более 4-6 часов).
Кратность экстракции приводит к увеличению выхода вещества за счет поступления новых порций растворителя. Для извлечения искомых соединений из внутренних органов возможны такие способы, как однократная и многократная экстракция, т.к. непрерывная экстракция требует специальной аппаратуры.
3) Немаловажную роль в экстракции играет и степень измельченности объекта, что обеспечивает максимальный доступ растворителя к искомому веществу (площадь соприкосновения твердой и жидкой фаз), но одновременно увеличивает количество соэкстрактивных веществ.
Вторая стадия изолирования «нелетучих» ядов заключается в выделении их из водного извлечения путем экстрагирования органическим растворителем, не смешивающимся с водой, при различных значениях рН среды. Этим достигается концентрирование вещества в извлечении и его частичная очистка от нормальных компонентов биоматериала (не растворимых в данном растворителе).
За счет экстрагирования веществ вначале из кислого, а затем из щелочного водного раствора, их можно разделить на 2 подгруппы:
1) Вещества, экстрагируемые органическими растворителями из кислого раствора (вещества кислотного, нейтрального и частично слабоосновного характера).
2) Вещества, экстрагируемые из щелочного раствора (вещества основного и частично слабоосновного характера).
Вещества со слабо выраженными основными свойствами могут частично перераспределяться из одной подгруппы в другую. К ним относятся производные пурина - кофеин, теобромин, теофиллин; опийные алкалоиды - папаверин, наркотин,; производные индола - бруцин, стрихнин; стероидоподобный алкалоид - вератрин, некоторые синтетические лекарственные средства - антипирин, амидопирин, промедол, производные фенотиазина (аминазин) и др.
Для веществ нейтрального характера, не способных к ионизации, практически не требуется создания определенного значения рН, т.к. они экстрагируются органическим растворителем в молекулярной форме из любой среды. Разделение веществ на 2 подгруппы в значительной степени облегчает проведение последующего ненаправленного анализа с целью обнаружения неизвестного яда.
На второй стадии изолирования продолжают играть свою роль уже рассмотренные выше факторы, такие, как
1) растворимость яда, которая определяется степенью ионизации a и регулируется рН среды.
2) природа экстрагента, его объем, время и кратность экстракции.
Если на первой стадии изолирования веществ данной группы мы стремились перевести их в ионизированное состояние и сделать водорастворимыми, то на второй стадии наша задача заключается в том, чтобы перевести вещества в неионизированную (молекулярную) форму (a®0), которая хорошо экстрагируется из водной фазы неполярным органическим растворителем. Необходимое для этого значение рН может быть рассчитано из уравнения, имеющего следующий вид:
рН = рКa - 2(3) для кислот
рН = рКa + 2(3) для оснований
Понятно, что для веществ кислого характера на этой стадии требуется создание кислой среды, а для основных – щелочной.
В качестве экстрагентов веществ из водной фазы подбирают неполярные органические растворители, которые:
а) не смешиваются с водой и по удельному весу (d) значительно отличаются от нее, что предотвращает образование эмульсий в процессе экстрагирования (d¹1,0)
б) имеют низкую температуру кипения, что облегчает их упаривание из экстракта
в) хорошо растворяют изолируемое вещество и обеспечивают высокий коэффициент распределения его между водной и органической фазами (Кр = С0/Св)
Коэффициент распределения можно увеличить, добавив в водную фазу электролит, который способствует вытеснению вещества из водной фазы в слой органического растворителя за счет понижения его растворимости в воде (разрушение сольватной оболочки молекул). В качестве электролита используют Na2SO4, (NH4)2SO4, NaCl.По данным проф. В.Ф.Крамаренко, наиболее подходящим электролитом при изолировании алкалоидов является сульфат аммония.
Наличие электролита в водной фазе приводит также к осаждению белков, что служит своеобразной очисткой полученного извлечения. Избыточное количество электролита, особенно при изолировании соединений кислотного характера, может привести к значительным потерям искомых веществ за счет их осаждения.
Исходя из перечисленных выше требований, наиболее подходящим экстрагентом для веществ кислотного характера является эфир, а для веществ основного характера - хлороформ.
Объем экстрагента, время и кратность экстракций.
Необходимый объем экстрагента при однократной экстракции можно рассчитать, исходя из уравнения степени экстракции (Е)
100 * Кр
Е = ---------------------- %, где
Кр + uН2О/uорг
Кр - коэффициент распределения
uН2О - объем водной фазы
uорг - объем органической фазы
Время экстракции обычно не превышает 5 минут, т.к. экспериментально доказано, что за этот период времени большинство органических соединений переходит из водной в органическую фазу.
Кратность экстракции обычно составляет 2-3, что обеспечивает полноту извлечения вещества за счет поступления свежих порций растворителя.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2297; Нарушение авторских прав?; Мы поможем в написании вашей работы!