
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лактим-лактамная таутомерия барбитуратов
В водных растворах барбитураты обладают кислотными свойствами (рКа 7-8). Это объясняется тем, что барбитураты в зависимости от рН среды способны существовать в нескольких таутомерных формах:
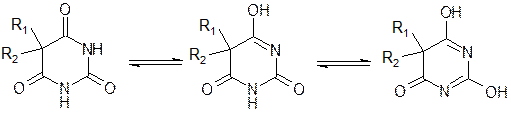 |
рН=2 рН=10 рН=13
лактамная лактимная дилактимная
Форма форма форма
В случае N-замещенных производных возможно образование только лактимной структуры, т.к. второй атом N замещен радикалом (R3).
Кислотные свойства обусловлены тем, что атомы водорода гидроксильных групп способны отщепляться в виде ионов, подобно тому, как это происходит в фенольном гидроксиле, и замещаться на атом Ме, образуя солеобразные соединения.
На лактим-лактамной таутомерии барбитуратов основано получение их натриевых производных, которые, в отличие от лактамных форм, хорошо растворяются в воде (мединал - производное барбитала, барбамил, этаминал-натрий, гексенал, тиопентал). В то же время, Na-производные плохо растворяются в органических растворителях, таких, как эфир, хлороформ, бензол, дихлорэтан и других. Лактамные формы, наоборот, хорошо растворимы в указанных органических растворителях, спирте, щелочах (в последних за счет образования Na-производных).
Способность барбитуратов существовать в нескольких таутомерных формах и различная растворимость этих форм в воде и органических растворителях используется для их изолирования и очистки при выделении из биологического материала.
На этом же свойстве барбитуратов основано исследование их в УФ-области спектра, т.к. таутомерные формы обладают различным светопоглощением.
Химико-токсикологическое исследование биологического материала на наличие производных барбитуровой кислоты состоит из этапов:
1. Изолирование из объекта
2. Очистка полученного извлечения
3. Идентификация
4. Количественное определение
1 Этап. Выбор метода изолирования определяется характером объекта исследования и поставленными перед химиком задачами.
Для целей клинического исследования в случае острых отравлений, а также в судебно-химической лаборатории, когда объектами исследования являются промывные воды желудка, диализат, небольшое количество крови и мочи, извлечение барбитуратов проводится непосредственно экстракцией органическим растворителем. В качестве экстрагентов используются эфир, хлороформ, дихлорэтан и др. Количество извлеченных барбитуратов составляет 70-90%. Однако, непосредственная экстракция, как правило, дает извлечения, загрязненные соэкстрактивными веществами (жирами, белками, пигментами) и требует последующей дополнительной очистки.
При исследовании трупного материала (внутренних органов)
а) при общем (ненаправленном) судебно-химическом анализе изолирование барбитуратов проводится подкисленным спиртом и подкисленной водой. Последующая экстракция их из кислого водного раствора осуществляется органическим растворителем, чаще эфиром или хлороформом. Максимальные количества барбитуратов извлекаются в интервале рН 1-3, т.к. при данном значении рН барбитураты существуют в молекулярной форме, которая хорошо растворяется в органических растворителях и ограниченно в воде. Изолирование подкисленной водой и подкисленным спиртом обеспечивает выход барбитуратов порядка 25-30% (некоторые барбитураты изолируются этанолом на 50% - барбамил, этаминал-Na, фенобарбитал).
б) При специальном (частном, направленном) исследовании на производные барбитуровой кислоты проводят извлечение подщелочной водой по методу Валова. Выход барбитуратов> 50% при достаточной чистоте выделенных веществ. Существует ряд методов, основанных на изолировании барбитуратов органическими растворителями (ацетонитрилом, ацетоном, хлороформом, смесью спирта и хлороформа) с последующей очисткой выделенных веществ.
2 Этап. Очистка извлеченных барбитуратов от балластных веществ.
Как правило, барбитураты, выделенные из биологического материала, содержат примеси посторонних веществ, которые извлекаются совместно с барбитуратами и являются нормальными компонентами организма (жиры, белки, пигменты, дубильные, смолобразные вещества и др.). Соэкстрактивные (балластные) вещества мешают дальнейшей идентификации и определению барбитурата.
Выбор метода очистки зависит, в основном, от количества изолированного вещества и до некоторой степени от его химического строения. При больших количествах барбитуратов чаще используют экстракционный метод очистки и микросублимацию (возгонку).
Экстракционная очистка основана на способности барбитуратов к имидо-имидольной таутомерии и на различной растворимости имидной и имидольной форм в воде и органических растворителях. Используя реэкстракцию барбитурата раствором гидроксида натрия из органической фазы, тем самым освобождаются от сопутствующих веществ, не растворимых в воде (натриевые соли хорошо растворимы в воде и извлекаются ею). Последующее выделение барбитурата из водной фазы проводят после подкисления водного раствора (рН 2) экстрагированием органическим растворителем. При этом барбитурат в молекулярной форме извлекается органическим растворителем, а в водной фазе остаются балластные вещества, не растворимые в органическом растворителе.
Микросублимация основана на способности барбитуратов возгоняться без разложения при нагревании. Возгонка проводится в нагревательной камере прибора Кофлера, либо, в упрощенном виде, с одного предметного стекла на другое, верхнее из которых охлаждается, а нижнее (с исследуемым остатком) нагревается.
При малых количествах выделенных веществ чаще используют хроматографические методы очистки (ионообменную и гель-хроматографию на колонке, ТСХ, ВЭТСХ, ВЭЖХ).
С точки зрения простоты, доступности и разрешающей способности наибольшего внимания заслуживают ТСХ, ВЭТСХ. Они позволяют не только очистить выделенные вещества от примесей, но и разделить целый ряд барбитуратов при их совместном присутствии, а также отделить барбитураты от их метаболитов и провести предварительную идентификацию по величине Rf.
3 Этап. Для идентификации барбитуратов используют химические, физические и физико-химические методы анализа.
К химическим методом можно отнести реакции окрашивания барбитуратов. Наиболее известны реакции барбитуратов:
1. С солями кобальта в щелочной среде. В результате реакции образуется комплекс состава Со(NH3)6OH·Barb2, окрашенный в красно-фиолетовый цвет. Чувствительность реакции 30 мкг. Реакция неспецифична для барбитуратов. Ее могут давать и другие соединения, по химическому строению сходные с барбитуратами (теобромин, теофиллин, биурет, некоторые сульфаниламиды).
2. С солями меди в присутствии пиридина образуется комплекс состава Cu·Pyr2·Вarb2) красно-фиолетового цвета (тиобарбитураты - зеленого цвета).
3. С солями ртути в присутствии дифенилкарбазона (ДФК) барбитураты образуют комплексные соединения, окрашенные в сине-фиолетовый цвет. Реакция широко используется для обнаружения барбитуратов на хроматограмме. Чувствительность ее достигает 0,5 мкг. Реакция неспецифична для барбитуратов.
4. Мурексидная проба (дают также пуриновые алкалоиды).
В микрокристаллоскопическом анализе барбитуратов использована их способность давать характерные кристаллические осадки при взаимодействии с солями тяжелых металлов (хлорцинкйодом, железо - и меднойодидным комплексами, меднопиридиновым реактивом) и выпадать в осадок из растворов концентрированной серной кислоты при понижении ее концентрации (выделение кислотной формы барбитурата).
Формы образующихся кристаллов характерны для каждого отдельного барбитурата. Чувствительность реакций достигает мкг и даже десятых долей мкг.
Обладая высокой чувствительность, доказательностью и специфичностью, микрокристаллические реакции не лишены и ряда недостатков:
-их проведение требует высокой степени чистоты исследуемого вещества,
-наличие примесей снижает чувствительность реакции, а также мешает правильной кристаллизации,
-производные барбитуровой кислоты склонны к полиморфизму образующихся кристаллов. В зависимости от ряда факторов - концентрации вещества, скорости кристаллизации, температуры, наличия посторонних примесей- барбитураты способны образовывать кристаллы различной формы, что затрудняет идентификацию отдельных веществ по форме кристаллов.
Из физических и физико-химических методов анализа применение нашли: ТСХ, ВЭТСХ, ВЭЖХ, спектроскопия в УФ и ИК областях спектра.
Хроматография в тонком слое и ВЭТСХ используются в качестве предварительного испытания на наличие производных барбитуровой кислоты. Они дают возможность разделить несколько барбитуратов при их совместном присутствии и идентифицировать каждый барбитурат в случае комбинированного отравления. ТСХ позволяет также отделить барбитураты от их метаболитов и провести очистку полученного извлечения от балластных веществ. Хроматографирование ведут на закрепленном слое силикагеля в системах растворителей:
1) хлороформ-ацетон (9:1) -для разделения N - замещенных и 5,5-замещенных производных, система является общей в скрининге лекарственных веществ кислого и нейтрального характера.
2) толуол – ацетон – этанол - 25% раствор аммиака (45:45:7,5:2,5) (применяется в экспресс- анализе интоксикаций)
3) хлороформ - н-бутанол - 25% раствор аммиака (70:40:5) - в качестве частной системы для разделения 5,5 -замещенный барбитуратов.
Детектирование веществ на хроматограмме проводится двумя реагентами: дифенилкарбазоном (ДФК) и НgSО4. При этом в местах расположения барбитуратов возникают красно- или сине-фиолетовые пятна. Идентификация проводится по величине Rf (отношение длины пробега вещества к длине пробега растворителя). Хроматографирование ведут параллельно метчикам (А), в качестве которых используют хлороформные растворы барбитуратов с известной концентрацией.
| Применение метчиков наряду с расчетом Rf обусловлено невоспроизводимостью Rf из-за трудности соблюдения стандартных условий при хроматографировании. Чувствительность реакции барбитуратов с ДФК и HgSO4 достигает 0,5мкг, однако, она неспецифична, поэтому дальнейшее подтверждение присутствия барбитурата производится микрокристаллическими реакциями и исследованием в УФ области спектра после элюирования вещества с хроматограммы подходящим растворителем. |
Спектроскопическое исследование барбитуратов чаще проводят в области длин волн 200-400 нм, т.е. в УФ области спектра, получая электронные спектры поглощения (что обусловлено наличием в структуре системы хромофоров и ауксохромов). Способность барбитуратов к абсорбции в УФ области связана с их таутомерными превращениями.
Для 5,5-замещенных производных:
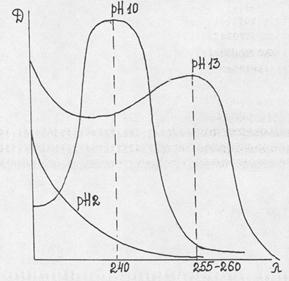
| 1. Имидная форма (рН 2) не абсорбирует в УФ области, т.к. здесь отсутствует хромофорная система (система сопряженных простых и двойных связей). 2. Имидольная форма (рН 10) уже имеет такую систему и обладает характерным погло-щением с lmax=240 нм 3. Диимидольная форма также обладает характерным поглощением с lmax=255-260нм. Здесь происходит удлинение хромофорной системы за счет образования еще одной двойной связи и, соответственно этому, батохромный сдвиг максимума (в длинноволновую область). |
В отличие от 5,5-дизамещенных барбитуратов, трехзамещенные имеют лишь одну ионизированную форму (имидольную), поэтому их поглощение не меняется с переходом от рН 10 к рН 13, и они обладают одним максимумом в щелочной среде при длине волны 245 нм.
Тиобарбитураты особенно удобны для исследования в УФ области, т.к. имеют два максимума в кислом растворе (239-290 нм), в щелочном при рН=10 также два максимума (255 и 310 нм) и при рН 13 - один (310нм).
Таким образом, УФ-спектроскопия дает возможность дифференцировать барбитураты в зависимости от типа замещения в пиримидиновом кольце на:
1. Двузамещенные (рН 2 - нет max, рН 10 - 240 нм, рН 13 -255-260 нм)
2. Трехзамещенные (рН 2 - нет max, рН 10 и рН 13 -245 нм)
3. Тиобарбитураты (рН 2 - 239 нм и 290 нм, рН 10 - 255 и 310 нм, рН 13 - 310 нм).
Однако, дифференциация отдельных представителей внутри каждого из типов замещения затруднительна, т.к. их спектры сходны между собой.
Применение спектральных методов анализа требует высокой степени чистоты выделенных веществ и должно сочетаться с их хроматографической очисткой.
Заключение о присутствии барбитуратов дается по комплексу результатов реакций, ХТС и УФ-спектроскопии.
4 Этап. Для количественного определения барбитуратов в настоящее время используется спектрофотометрический метод. При спектрофотометрическом определении барбитуратов, выделенных из биологического материала, используют принцип дифференциальной спектрофотометрии, т.к. прямому СФ-определению мешают посторонние вещества, извлекающиеся из объекта исследования совместно с барбитуратами.
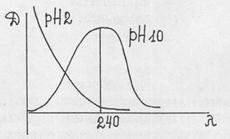 В I варианте концентрацию барбитурата в растворе (после его элюирования с хроматограммы) определяют по разности абсорбций в щелочном - рН 10 и кислом - рН 2 растворах при l=240 нм.
В I варианте концентрацию барбитурата в растворе (после его элюирования с хроматограммы) определяют по разности абсорбций в щелочном - рН 10 и кислом - рН 2 растворах при l=240 нм.
DD=DpH10-DpH2
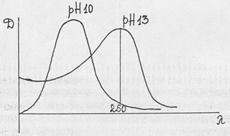 Во II варианте - по разности абсорбций в щелочных - рН 13 и рН 10 растворах при l=260нм.
Во II варианте - по разности абсорбций в щелочных - рН 13 и рН 10 растворах при l=260нм.
DD=DpH13-DpH10
Использование принципа дифференциальной спектрофотометрии возможно, когда поглощение примесей при выбранной длине волны не зависит от рН среды. Тогда при вычитании оптических плотностей происходит уничтожение абсорбции примесей, что дает возможность получать истинные результаты количественного определения.
Например,
В 1 варианте -DpH 10 = D10 + D10
l 240 нм
D pH 2 = 0 2 + D 2
DD = DpH10 - DpH2 = (D10 + D10) – D2
D10 = D2 DD = D10
Если поглощение примесей одинаково при рН 10 и при рН 2 (при 240 нм), то при вычитании они взаимно уничтожаются и остается поглощение барбитурата. Таким образом, снимается влияние примесей на результаты количественного определения
во II варианте - D pH13 =D13 + D 13
l 260 нм
D pH10 =D 10 + D 10
DD = D pH13 - D pH10 = (D13 + D 13 ) – (D 10 + D 10 )
D 13 = D 10
DD = D 13 - D 10
т.е. поглощение DD обусловлено самим барбитуратом и нет искажения результатов за счет примесей.
Расчет концентрации ведут по уравнению закона Бугера-Ламберта-Бера:
DD = Е 1% · l · С, откуда С = DD/Е 1% · l
1 см 1 см
где С - концентрация вещества в %;
DD - дифференциальная оптическая плотность (абсорбция);
Е 1% -удельный показатель поглощения (численно равен поглощению 1% раствора). Рассчитывается заранее для каждого барбитурата по растворам с известной концентрацией.
l - толщина светопоглощающего слоя (1 см)
С точки зрения чувствительности определения наиболее выгодным оказывается 1 вариант, т.к. он дает большую DD. Однако, в коротковолновой области при l=240 нм сильнее проявляется мешающее влияние примесей, поэтому чаще этот вариант используют в сочетании с предварительной хроматографической очисткой.
Во 2 варианте DD несколько меньше, в связи с чем ниже и чувствительность определения, но одновременно снижается влияние примесей в более длинноволновой области при 260 нм. Поэтому увеличивается надежность определения. Этим вариантом можно пользоваться даже без предварительной хроматографической очистки, например, при работе с биологическими жидкостями (кровь, моча), не подвергшимися гнилостному разложению.
Определение концентрации барбитуратов в биологических жидкостях позволяет:
а) установить тяжесть отравления и контролировать эффективность проводимого лечения в условиях клиники при острых отравлениях барбитуратами.
б) в посмертных случаях позволяет сделать заключение о приеме токсических или терапевтических доз, т.е. ответить на вопрос - явилось ли найденное вещество причиной смерти.
Токсические уровни барбитуратов в крови обычно превышают десятки мкг/мл, а при тяжелых отравлениях, заканчивающихся смертельным исходом, - сотни мкг/мл.
Токсикологическое значение барбитуратов обусловлено, с одной стороны, их сильным фармакологическим действием (список Б, барбамил и этаминал - список А), а с другой стороны - сравнительной доступностью для населения, о чем мы уже говорили выше.
Опасность отравления усиливается способностью барбитуратов к кумуляции, т.е. накоплению в организме даже при приеме терапевтических доз. В настоящее время известно о возможном пристрастии к этой группе препаратов и о синергизме при совместном приеме с алкоголем, опиатами и психотропными средствами (транквилизаторами, алкалоидами белладонны и др.), что усиливает токсикологическое значение барбитуратов.
Токсичность. Смертельной дозой барбитуратов считают одномоментный прием 10 лечебных разовых доз каждого из препаратов или их смеси с различными индивидуальными различиями (фенобарбитал -2,0, этаминал-Na -1,0). Иногда же эта доза достигает 4 и даже 6-10 г (барбитал).
|
Дата добавления: 2014-01-04; Просмотров: 5300; Нарушение авторских прав?; Мы поможем в написании вашей работы!