
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение порядка реакции
|
|
|
|
Молекулярность реакции
Молекулярность реакции определяется числом молекул, одновременно сталкивающихся и приводящих к химическим превращениям. Взаимодействия подобного рода носят название элементарного акта химического превращения. Молекулярность реакции, в отличие от порядка, имеет вполне определенный физический смысл. Например, реакция: I2=2I – мономолекулярная, так как в основе ее лежит распад исходного вещества; реакция H2+I2=2HI – бимолекулярная. Реакция 2NO+H2=N2O+H2O является примером тримолекулярной реакции. Молекулярность более высокого порядка не встречается, так как одновременное столкновение четырех частиц почти невероятно.
В случае сложных реакций, протекающих в несколько стадий, нет смысла говорить о молекулярности реакции в целом, так как это понятие применимо только к отдельным стадиям, представляющим элементарные химические акты.
Следует еще раз подчеркнуть, что молекулярность и порядок реакции – разные понятия. Численные их значения могут совпадать лишь в элементарных актах химических превращений. В общем случае они не совпадают.
В чём дело?
2HI + H2O2 ® I2 + 2H2O
Кажущаяся молекулярность равна 3; порядок реакции (экспер.)
равен 2
а) HI + H2O2 ®HOI + H2O медленно молекулярность 2; порядок 2
б) HI + HOI ®I2 + H2O быстро
Скорость любой сложной реакции определяется скоростью наиболее медленной стадии (скоростью лимитирующей стадии). Экспериментально найденный порядок соответствует молекулярности скорость лимитирующей стадии.
Итак, различие понятий «порядок» и «молекулярность реакции» можно свести к следующему: 1) молекулярность реакции имеет вполне определенный физический смысл, а порядок реакции – величина формальная; 2) порядок может принимать любые значения: целые, дробные и даже отрицательные, численные значения молекулярности ограничены лишь тремя цифрами – 1,2,3; 3) понятие «порядок реакции» можно использовать для любых реакций (как сложных, так и простых), понятие «молекулярность» применимо только к элементарным актам химических превращений.
|
|
|
 Для определения порядка реакции часто используют способ подстановки. Он заключается в выборе уравнения кинетики реакции (нулевого, первого, второго порядка), при подстановке в которое экспериментальных данных, получается постоянное значение константы скорости реакции. Именно это уравнение и определяет порядок исследуемой реакции.
Для определения порядка реакции часто используют способ подстановки. Он заключается в выборе уравнения кинетики реакции (нулевого, первого, второго порядка), при подстановке в которое экспериментальных данных, получается постоянное значение константы скорости реакции. Именно это уравнение и определяет порядок исследуемой реакции.
Существует и графический способ определения порядка реакции.
Для реакции нулевого порядка скорость реакции не зависит от концентрации вещества и графически скорость реакции от концентрации дает прямую линию, параллельную оси абсцисс (рис.2).
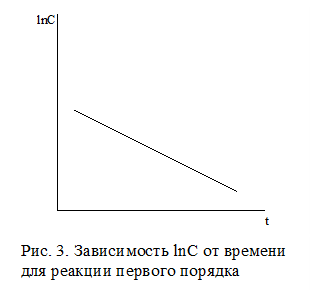
Для реакции первого порядка зависимость lnC от времени имеет прямолинейный характер (рис.3).
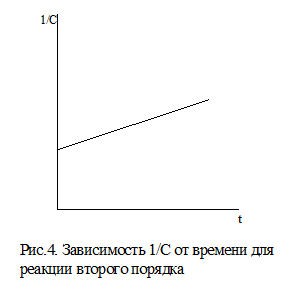
В случае реакции второго порядка зависимость 1/С от времени имеет прямолинейный характер. Эта зависимость показана на рис.4.
Зависимость скорости реакции от температуры
Правило Вант–Гоффа.
Общий характер зависимости скорости реакции от температуры графически можно представить на рис.
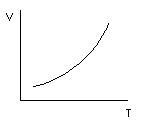
Впервые количественную зависимость константы скорости реакции от температуры дал Вант–Гофф в 1884 году Он установил, что при повышении температуры на 10 градусов скорость большинства реакций увеличивается в 2–4 раза. Математически эта зависимость выражается соотношением:

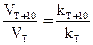 = g, (23)
= g, (23) 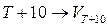

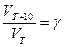
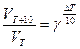
где: VT и kT соответственно скорость и константа скорости реакции при температуре Т; VТ + 10 и kТ + 10 – те же величины при температуре (Т + 10),
g= 2¸4– температурный коэффициент скорости реакции. В общем случае, если температура изменилась на
|
|
|
DТ = Т2 – Т1 градусов уравнение (23) принимает вид: I II III
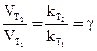 DТ/10 (24) ∆Ea
DТ/10 (24) ∆Ea
Это правило имеет ограниченное применение. Оно не распространяется как на очень быстрые реакции (ионные), так и на очень медленные реакции.
{Следует отметить, что правило Вант–Гоффа можно использовать тогда, если реакция проводится при температуре близкой к комнатной. С повышением температуры g уменьшается и для многих реакций при очень высоких температурах может стать даже меньше единицы, т.е. повышение температуры начинает вызывать не увеличение, а уменьшение скорости реакции.
Ферментативные процессы характеризуются более высокими значениями температурных коэффициентов (7–10), в особенности процессы денатурации белков. В таких случаях интервал в 100 может оказаться слишком широким и за полученными коэффициентами можно не заметить существенных изменений в механизме того или иного процесса. Во избежание этого рекомендуется брать более узкий интервал температур (20,30,50) и полученные результаты приводить к величине g 10 по формуле:
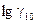 = 10
= 10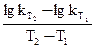 (25)
(25)
Все жизненные процессы протекают в узком температурном интервале, за пределами которого наступает смерть. Обычно это интервал температур от 00С до 45-500С.
Кривая зависимости скорости биологических процессов от температуры имеет три точки: минимум, оптимум и максимум. От минимума до оптимума интенсивность процессов увеличивается. Температурный оптимум у животных колеблется в пределах 35-400С, у растений он выше. Интервал от оптимума до максимума характеризуется уменьшением скорости протекания процессов. Температурные границы жизни обусловлены денатурационными изменениями белков и инактивацией ферментов.}
Более точный характер зависимости скорости от температуры даёт теория активных соударений
(В основе современной химической кинетики лежат две теории: теория активных соударений и теория активного комплекса.)
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2361; Нарушение авторских прав?; Мы поможем в написании вашей работы!