
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экстракция из клеточной массы
В микробиологической промышленности широко распространен процесс упаривания как один из способов предварительного концентрирования целевых продуктов. Упаривание проводится в одно- или многокорпусной вакуум-выпарной установке. В многокорпусных вакуум-выпарных установках происходит многократное упаривание культуральной жидкости, поступающей последовательно из одного аппарата в другой. Целевые продукты биосинтеза в основном неустойчивы к нагреванию (термолабильны) и могут в определенной степени инактивироваться при температурах 50 - 60°C в течение 5 - 15 мин. Поэтому процесс упаривания следует проводить при режимах, обеспечивающих минимальные потери биологической активности конечных продуктов. Для каждого конкретного продукта опытным путем определяется время пребывания в выпарном аппарате при соответствующей температуре.Для упаривания культуральных жидкостей принята температура 70 – 75 оС. Такая температура кипения достигается путем создания соответствующего разрежения в выпарных аппаратах.
Выпарной аппарат, показанный на рисунке, работает по принципу нисходящего потока. Культуральная жидкость из приемного бака насосом подается в верхнюю часть испарителя, где равномерно распределяется по верхней трубной решетке и стекает в виде тонкой пленки по внутренней поверхности труб. В межтрубное пространство первого испарителя подается свежий греющий пар. Образующийся при испарении культуральной жидкости пар, так называемый вторичный пар, стекает в том же направлении, что и жидкостная пленка по трубам, а затем поступает в отделитель жидкости. Здесь происходит отделение упаренной жидкости от вторичного пара. Вторичный пар с температурой 80 - 87 °С направляется в межтрубное пространство второго испарителя.
Сгущенная культуральная жидкость из нижней части первого испарителя и отделителя насосом направляется на вторую ступень упаривания, а затем на третью.
 Рисунок 13 - Трехкорпусная выпарная установка: 1 - испаритель; 2 – брызгоотделитель; 3- труба вторичного пара; 4 - испаритель II ступени; 5 - испаритель III ступени; 6 - поверхностный конденсатор; 7 –насосы; 8 - водокольцевой вакуум-насос.
Рисунок 13 - Трехкорпусная выпарная установка: 1 - испаритель; 2 – брызгоотделитель; 3- труба вторичного пара; 4 - испаритель II ступени; 5 - испаритель III ступени; 6 - поверхностный конденсатор; 7 –насосы; 8 - водокольцевой вакуум-насос.
|
5 В производстве некоторых биологически активных веществ, в частности антибиотиков, для отделения массы микроорганизмов от культуральной жидкости применяют метод фильтрования. Этот метод служит для отделения микроорганизмов-продуцентов, которые имеют нитевидную, ветвистую форму. Сущность фильтрования заключается в разделении твердой и жидкой фаз при пропускании культуральной жидкости через пористую перегородку. Движущей силой фильтрования является разность давлений по обе стороны перегородки. Одной из важнейших характеристик процесса фильтрования является его скорость, т. е. количество фильтрата, получаемого с единицы фильтрующей поверхности в единицу времени- W м3/(м2с):
 где V-объем фильтрата (м3); F- площадь фильтрующей поверхности (м2); τ-время (с).
где V-объем фильтрата (м3); F- площадь фильтрующей поверхности (м2); τ-время (с).
Скорость фильтрования зависит от давления, толщины слоя осадка, его структуры, вязкости жидкой фазы и других факторов. Фильтруемость культуральной жидкости зависит от вида микроорганизма-продуцента, качественного и количественного состава питательной среды, условий ферментации. Продуценты отличаются размерами и структурой клеточных образований. Например, продуцент пенициллина образует длинноволокнистый мицелий с «толстыми» нитями диаметром 5 - 10 мкм, отделение которого от жидкой фазы не представляет затруднений. Мицелий же актиномицетов характеризуется тонкими (0,2 - 1 мкм) ветвистыми нитями. К концу ферментации наблюдается значительный лизис клеток, в результате которого в жидкости образуется тонкодисперсная фракция взвеси, состоящая из обрывков мицелиальных клеток. Мицелий имеет аморфный, слизистый, липкий характер, быстро забивает поры фильтрующего материала. Удельное сопротивление осадка велико. Фильтрование этих культуральных жидкостей без предварительного улучшения фильтруемости практически невозможно. Для улучшения фильтруемости культуральные жидкости многих антибиотиков перед отделением мицелия подвергают специальной обработке. К способам улучшения фильтруемости культуральной жидкости относятся тепловая коагуляция, кислотная коагуляция, обработка жидкости электролитами и полиэлектролитами, образование наполнителя-коагулянта непосредственно в жидкости, применение фильтровальных порошков. Тепловая коагуляция используется в основном для антибиотиков, которые не разрушаются при нагревании в водной среде. Основана она на денатурации белка при повышенной температуре. При этом скорость фильтрования увеличивается за счет свертывания и коагуляции белков, что приводит к образованию ими жестких структур, изменяющих характер (структуру) осадка. Осадок при этом делается менее липким, легко обезвоживается. Кроме того, при повышенной температуре (70 - 75°С) значительно уменьшается вязкость культуральной жидкости. Однако тепловая обработка обычно неблагоприятно сказывается на качестве готового продукта. Кислотная коагуляция широко применяется в производстве антибиотиков, которые сравнительно устойчивы при низком значении рН раствора. Выбор кислоты для снижения рН определяется требованиями последующей химической очистки антибиотика. Однако кислотная коагуляция обеспечивает хорошую фильтруемость не для всех культуральных жидкостей. Хороший эффект в некоторых случаях дает совместная кислотно-тепловая коагуляция.
Широко практикуется для ускорения фильтрования культуральной жидкости применение фильтровальных порошков. Чаще всего используются силикатные порошки (перлит, диатомит и др.) или древесная мука. Порошок в виде водной суспензии подают на фильтр, нанося на его поверхность грунтовый (намывной) слой толщиной 1 - 2 мм., через который затем фильтруют культуральную жидкость. Благодаря высокой проницаемости грунтового слоя, скорость фильтрования увеличивается. Иногда порошки добавляют прямо в культуральную жидкость перед фильтрованием, однако в этом случае скорость фильтрования увеличивается всего на 15 – 20 %, в то время как с
 Рисунок 14 - Рамный фильтр- пресс: 1- лобовина, 2 – рама; 3-брус; 4 - подвижная лобовина; 5 - гидравлическое устройство; 7 – прилив; кран.
Рисунок 14 - Рамный фильтр- пресс: 1- лобовина, 2 – рама; 3-брус; 4 - подвижная лобовина; 5 - гидравлическое устройство; 7 – прилив; кран.
|
грунтовым слоем она выше в 1,5 - 2 раза. Перечисленные выше методы все же не являются достаточно эффективными. Они не позволяют изменить структуру осадка таким образом, чтобы можно было использовать для его отделения фильтры без намывного слоя.
Наиболее эффективным методом коагуляции, улучшающим характер осадка и повышающим скорость фильтрования, является метод образования наполнителя непосредственно в культуральной жидкости при добавлении реагентов, образующих нерастворимый осадок. Такими реагентами служат соли Са, Ва, Fe, Al и др., образующие в водной среде осадки с анионами серной, фосфорной, щавелевой и других кислот. Выпадающие в культуральной жидкости осадки предотвращают слипание частиц мицелия, способствуют образованию гранул. Мицелий приобретает комковатую структуру и образует при фильтровании проницаемый слой. Фильтры для отделения биомассы от культуральной жидкости. По принципу работы различают фильтры периодического и непрерывного действия. По характеру движущей силы фильтры делятся на работающие под давлением и под вакуумом. Из множества конструкций фильтров для отделения мицелия в производстве биопрепаратов нашли применение лишь барабанные вакуум-фильтры и рамные фильтр-прессы.
Рамный фильтр-пресс, схема которого изображена на рисунке, относится к аппаратам периодического действия, работающим под давлением. Фильтр-пресс состоит из чередующихся плит - 2 и рам - 3 одинаковых размеров, между которыми зажата фильтрующая ткань (салфетки). Плиты и рамы опираются боковыми ручками на два параллельных круглых бруса - 4. Плиты и рамы плотно прижимаются к лобовине при помощи подвижной лобовины - 5, на которую действует давление плунжера гидравлического устройства - 6.
Плиты имеют по краям гладкую поверхность, а в середине - рифленую с желобками. Плиты и рамы имеют приливы - 7 с отверстиями, которые при сборке образуют канал для подвода фильтрующей жидкости.
Процесс фильтрования на рамном фильтр-прессе осуществляется следующим образом. Культуральная жидкость под давлением подается в канал и из него через отверстия в стенке рамы поступает во внутреннюю полость (пространство), ограниченную двумя фильтровальными перегородками и внутренней поверхностью рамы. Мицелий задерживается в этом пространстве, а нативный раствор проходит через фильтрующие салфетки, после чего по желобам и каналам через краны стекает в лоток. Обычно первые порции фильтрата бывают мутными, их возвращают в сборник культуральной жидкости. В дальнейшем на ткани накапливается слой осадка, через который осуществляется фильтрование. Фильтрат становится при этом прозрачным.

|
| Рисунок 15 - Схема работы барабанного вакуум – фильтра: I –фильтрование; II-просушка; III- промывка и просушка; IV- отдувка и регенерация ткани |
После фильтрования осуществляют промывку мицелия. Цель промывки - вытеснить нативный раствор из осадка, чтобы обеспечить более полный переход. По окончании промывки мицелий на фильтре продувают сжатым воздухом для вытеснения промывных вод из пор осадка. Затем отодвигают подвижную плиту, разъединяют плиты и рамы и осадок удаляют в бункер, а фильтрующие полотна промывают струями воды. Проведение процесса фильтрования с постепенным повышением давления от 0 до 0,2 - 0,3 мПа обеспечивает более высокую производительность фильтра, чем в случае фильтрования при постоянном высоком давлении. Высокое давление в начальный момент фильтрования вызывает проникновение мелких частиц осадка в поры грунтового слоя в фильтрующей ткани, что приводит к их забиванию и снижению скорости фильтрования. Недостатки рамного фильтр-пресса заключаются в больших затратах физического труда, тяжелых в санитарном отношении условиях работы обслуживающего персонала и значительном снижении скорости фильтрования во времени. К преимуществам рамного фильтр-пресса можно отнести большую поверхность фильтрования на единицу занимаемой фильтром площади помещения, простоту конструкции, отсутствие движущихся частей, а также возможность получения прозрачного фильтрата.
Барабанный вакуум-фильтр представляет собой фильтр непрерывного действия, работающий под вакуумом. Фильтр имеет горизонтальный перфорированный барабан, покрытый снаружи фильтрующей тканью.
6. Как было сказано выше, конечным продуктом стадии ферментации является культуральная жидкость, содержащая суспензию микроорганизмов. Культуральные жидкости обычно являются сложными смесями большого числа компонентов, многие из которых обладают близкими физико-химическими свойствами. Наряду с растворенными минеральными солями, углеводами, белками и другими органическими веществами культуральные жидкости содержат в значительном количестве полидисперсные коллоидные частицы и взвеси. Следовательно, они являются не только многокомпонентными растворами, но и суспензиями. Дисперсная фаза этих суспензий состоит из мицелия или клеток микроорганизмов, а также из твердых частиц, содержащихся в большинстве питательных сред - муки, хлопьев из кукурузного экстракта и т.п. Характерной особенностью культуpaльных жидкостей является сравнительно низкое содержание целевых продуктов. Например, содержание биомассы при производстве дрожжей составляет 5 - 10 %, а при производстве бактериальных препаратов не превышает 1 - 2 %. Большинство целевых продуктов микробиологического синтеза нестабильны и подвержены влиянию различных факторов. Белки, например, исключительно чувствительны к нагреванию, изменению рН среды, ко многим физическим и химическим воздействиям. При разработке технологии выделения целевых продуктов необходимо учитывать не только физико-химические свойства культуральных жидкостей, низкую концентрацию целевого продукта в них и его лабильность, но и вид готовой товарной формы биопрепарата. Выбор товарной формы биопрепаратов зависит от свойств продукта, удобства применения, сохранения биологических свойств при хранении и транспортировке и т. д. Целевым продуктом микробиологического синтеза может быть, либо сама биомасса микроорганизмов (инактивированная или живые клетки), либо продукты метаболизма, растворенные в культуральной жидкости или находящиеся внутри клеток. Получение микробиологических концентратов по сравнению с другими биопрепаратами на стадии выделения конечного продукта отличается наиболее простой технологией. Общим для всех микробиологических концентратов является удаление воды полностью или частично. Основные технологические операции при получении концентратов - это упаривание и сушка.
Технология упаривания культуральной жидкости изложена в предыдущем разделе. В данном разделе рассмотрим процесс сушки биомассы на примере производства белково-витаминного концентрата (БВК) на парафинах нефти. Для получения белковых препаратов, пригодных к длительному хранению и транспортировке, биомассу клеток необходимо высушить до влажности 8- 10%. В более влажном состоянии масса микроорганизмов быстро теряет ценные биологически активные вещества и начинает разлагаться.
Клеточная суспензия после упаривания с содержанием сухих веществ 15 – 20% подвергается сушке в специальных сушильных установках.

| Рисунок 16 - Двухвальцовая паровая сушилка непогруженного типа: 1- продольный шнек; 2 – нож; 3-клинья; 4 –барабаны; 5 – крышки; 6 - труба для вывода конденсата. |
Вальцовые сушилки применяются на предприятиях малой мощности. Процесс сушки в таких аппаратах происходит в результате соприкосновения суспензии биомассы с горячей поверхностью вращающегося барабана. По конструкции эти сушилки бывают одно- и двухвальцовые, непогруженные и погруженные. Двухвальцовая сушилка не погружного типа ВСГ состоит из двух стальных полых горизонтально расположенных барабанов. В барабаны, которые закрыты с торцов крышками, подается пар. Барабаны монтируются строго параллельно. У торцов барабанов сверху устанавливаются клинья, образующие между барабанами ванну, в которую непрерывно поступает концентрат биомассы.
| Рисунок 17 - Двухвальцовая паровая сушилка погружного типа: 1 – сборник; 2 – нож; 3 – барабаны; 4 – ванны; 5 – мешалки; 6 - теплообменник. |
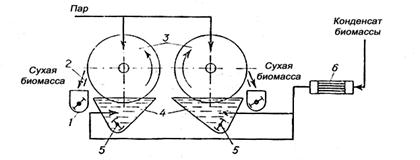 Концентрат биомассы нагревается в ванне до температуры около 100°С и часть воды при этом испаряется. При вращении барабанов навстречу друг другу клеточная биомасса намазывается на их поверхность тонким слоем и высушивается до влажности 8 - 10%. Сухая биомасса снимается с поверхности барабанов ножами и осыпается в продольные шнеки, откуда подается па фасовку.
Концентрат биомассы нагревается в ванне до температуры около 100°С и часть воды при этом испаряется. При вращении барабанов навстречу друг другу клеточная биомасса намазывается на их поверхность тонким слоем и высушивается до влажности 8 - 10%. Сухая биомасса снимается с поверхности барабанов ножами и осыпается в продольные шнеки, откуда подается па фасовку.
Двухвальцовая сушилка погружного типа СДА 1200/3600 отличается от описанной выше тем, что в ней сушильные барабаны погружены в ванну с клеточной суспензией и работают самостоятельно. Суспензия в ванне перемешивается мешалкой, а перед подачей в ванну подогревается в теплообменнике. Потери белка на вальцовых сушилках достигают 15%.
 Распылительные сушилки применяются в производстве многих продуктов микробиологического синтеза. Они различаются способом взаимодействия высушиваемого материала с сушильным агентом (прямоточные, противоточные или смешанные), температурой и составом газа-носителя, устройством распылительного механизма и т. д.
Распылительные сушилки применяются в производстве многих продуктов микробиологического синтеза. Они различаются способом взаимодействия высушиваемого материала с сушильным агентом (прямоточные, противоточные или смешанные), температурой и составом газа-носителя, устройством распылительного механизма и т. д.
Наиболее производительными являются распылительные сушилки, применяемые для сушки кормовых дрожжей. На рисунке представлена схема распылительной сушилки с центробежным распылением и с нижним подводом сушильного агента.
| Рисунок 18 - Сушилка с центробежным распылением: 1 - центробежный распылительный механизм; 2 - направляющий аппарат; 3 - газопроводник теплоносителя; 4 - сушильная камера; 5 - затвор для сбора продукта; 5 - труба пневмотранспорта. |
Дрожжевая суспензия непрерывно подается под небольшим давлением в распылительный механизм, который представляет собой диск с лопастями. Под действием центробежной силы, возникающей при вращении диска, раствор в виде пленки перемещается с непрерывно возрастающей скоростью к периферии диска и сбрасывается в виде струек, распадающихся на мельчайшие капли размером 60 - 70 мкм. Сушильный агент (нагретый воздух или дымовые газы, разбавленные воздухом) подается в сушильную камеру по газопроводу, который заканчивается направляющим аппаратом. При помощи направляющего аппарата создается большая скорость движения теплоносителя на входе в сушильную камеру и одновременно сообщается спиралеобразное направление движению теплоносителя. Начальная температура сушильного агента при сушке кормовых дрожжей достигает 300 - 350 °С. Распыленная дрожжевая суспензия, вступая в контакт с теплоносителем, теряет воду - высушивается. Испарение воды из дрожжевой суспензии при высокой степени распыления протекает практически мгновенно, благодаря чему сушильный агент быстро охлаждается и температура его на выходе из сушилки не превышает 100 °С. Высушенные дрожжи также не прогреваются выше этой температуры. Сухие кормовые дрожжи в виде порошка падают в нижнюю конусную часть сушилки, откуда непрерывно удаляются. Отработанный теплоноситель отводится из сушильной камеры. Часть дрожжей (15 – 20 %) уносится вместе с теплоносителем и для их улавливания устанавливаются специальные пылеулавливающие аппараты - циклоны. Сухие дрожжи из-под конуса сушилки и из циклонов подаются пневмотранспортом на фасовку и упаковку. Распылительные сушилки являются весьма сложными и небезопасными устройствами в эксплуатации, поэтому их работу стремятся автоматизировать. Автоматическое управление процессом сушки позволит интенсифицировать процесс сушки, повысить качество получаемого продукта, сократить удельные расходы топлива и энергии.
Выделение продуктов метаболизма из культуральной жидкости
Если биологически активное вещество, например антибиотик, находится в культуральной жидкости в растворенном состоянии, то для извлечения его применяют экстракцию или ионообменный метод.
Метод жидкостной экстракции
Жидкостная экстракция представляет собой процесс извлечения веществ одной жидкостью из другой. Из воды вещество экстрагируют органическим растворителем, а из органического растворителя - водой. Обычно используют такой органический растворитель, который не смешивается с водой. Таким образом, в процессе экстракции участвуют две жидкие фазы - экстрагент и исходный раствор. Получаемые после экстракции фазы называются экстрактом и рафинатом (или отработанным раствором). Метод экстракции позволяет не только извлечь целевой компонент из культуральной жидкости, но и отделить его от значительного числа сопутствующих примесей и сконцентрировать. Для экстракции к определенному объему водного раствора вещества, например, антибиотика, прибавляют определенный объем органического растворителя (экстрагента), нерастворимого или слаборастворимого в воде. Водную и органические фазы перемешивают и затем разделяют отстаиванием или центрифугированием. В результате получают экстракт и отработанный раствор. В лабораторной практике экстракцию проводят в делительных воронках. Основной характеристикой процесса экстракции является коэффициент распределения Кр, который представляет собой отношение равновесной концентрации распределяемого вещества в органической фазе Со (экстракте) к его равновесной концентрации в водной фазе Св (рафинате).:

По значению коэффициента распределения судят об экстракционной способности экстрагента. Чем выше КР, тем выше способность данного экстрагента извлекать целевой компонент. Количество извлеченного вещества увеличивается с ростом продолжительности экстракции. Однако для многих биологически активных веществ, лабильных в процессе экстракции, время экстракции необходимо сокращать. Кроме того, переработка больших объемов культуральной жидкости (десятки тонн) также требует уменьшения продолжительности экстракции. Для того чтобы увеличить скорость процесса экстракции, необходимо максимально развить поверхность взаимодействия между фазами. Это может быть достигнуто интенсивным диспергированием экстрагента на мелкие капли с равномерным распределением их в другой

Рисунок 19 - Струйный инжектор – сместитель: 1- сопло; 2 – отверстия; 3 – штуцер; 4 -всасывающий трубопровод.
жидкости. При этом не только возрастает площадь поверхности соприкосновения фаз, но и значительно уменьшается сопротивление переходу извлекаемого вещества. Увеличению скорости процесса экстракции способствует также создание противоточного движения жидкостей. В этом случае еще не содержащий целевого компонента экстрагент контактирует с обедненным раствором, тогда как при прямотоке насыщенный целевым компонентом экстрагент контактирует с исходным раствором. Большинство культуральных жидкостей содержат белки, высшие амины, соли жирных кислот, которые являются эмульгаторами. При диспергировании экстрагента и культуральной жидкости образуется стойкая эмульсия, неполное разделение которой приводит к потере как целевого компонента, так и растворителя. Наиболее эффективно разрушение эмульсии происходит под действием центробежных сил. Длительность разрушения эмульсии должна быть минимальной (не более 10 с.). Поэтому экстракцию, например, антибиотиков проводят либо в центробежных экстракторах-сепараторах, в которых одновременно осуществляются процесс экстракции и разрушение образовавшейся эмульсии, либо и две стадии - в одном аппарате - процесс экстракции, а в центробежных сепараторах или суперцентрифугах - разделение эмульсии.
На заводах малой производительности применяют периодическую экстракцию, которую проводят в аппарате с мешалкой и коническим днищем типа делительной воронки. Аппарат снабжен рубашкой для охлаждения. В аппарат заливают определенные объемы культуральной жидкости и экстрагента, включают мешалку и приливают раствор кислоты или шелочи до установления требуемого значения рН. Перемешивают в чеченце 10 - 20 мин., выключают мешалку затем разделяют водную и органическую фазы под действием силы тяжести или сепарацией. На заводах, где перерабатываются десятки и сотни тонн культуральной жидкости в сутки применяется непрерывная экстракция. Культуральную жидкость и органический растворитель из емкостей непрерывно подают насосами в определенных количествах на смешение в смеситель-экстрактор. Полученная в смесителе эмульсия для разделения направляется в тарельчатые сепараторы или трубчатые сверхцентрифуги.
Аппараты для экстракции
При раздельных процессах экстракции и сепарирования чаше всего используют струйный cместитель – инжектор, в котором достигается тонкое диспергирование жидкостей. Конструкция таких смесителей проста и удобна, так как отсутствуют движущиеся части. Сепаратор специально разработан для производства антибиотиков. Эмульсия подается в сепаратор сверху, проходит через отверстия тарелкодержателя и поступает в камеру барабана, где находится комплект разделительных тарелок. В тарелках имеется два концентрических ряда отверстий, проходя через которые жидкость заполняет межтарелочные зазоры. При вращении ротора сепаратора с частотой 4000 - 7000 об/мин создается центробежная сила, под действием которой более тяжелая жидкость отбрасывается к периферии барабана, стекая вниз по тарелкам, а легкая поднимается вдоль тарелок.
| Рисунок 20 - Схема работы тарельчатого барабана сепаратора при разделении эмульсий |
 Тяжелая жидкость, поднимаясь по периферии барабана, огибает верхнюю разделительную тарелку (горловину) и через отверстия в крышке непрерывным потоком выводится из барабана. Легкая фракция выходит из барабана через кольцевой зазор между тарелкодержателем и горловиной.
Тяжелая жидкость, поднимаясь по периферии барабана, огибает верхнюю разделительную тарелку (горловину) и через отверстия в крышке непрерывным потоком выводится из барабана. Легкая фракция выходит из барабана через кольцевой зазор между тарелкодержателем и горловиной.
Трубчатая сверхцентрифуга также предназначена для разделения эмульсии, получаемой в смесителе. Основным ее элементом является полый цилиндр - ротор, вращающийся с частотой 13000 - 15000 об/мин. Разделяемая эмульсия поступает в ротор снизу. Поднимаясь вдоль вращающегося ротора, она приводится в интенсивное вращение и расслаивается под действием центробежной силы. При этом жидкость, обладающая большей плотностью (тяжелая), движется по периферии барабана, а жидкость с меньшей плотностью (легкая) - по его центральной зоне. В верхней части центрифуги имеется два приемника, через которые непрерывно отводятся тяжелая и легкая фракции разделенной смеси.
Применение экстракционных установок непрерывного действия, состоящих из одного смесителя и одного сепаратора, т. е. осуществляющих одноступенчатую экстракцию, часто не обеспечивает достаточной степени извлечения вещества. Для уменьшения потерь антибиотика с отработанным раствором осуществляют многократную (многоступенчатую) противоточную экстракцию. В этом случае экстракцию проводят в многоступенчатых центробежных экстракторах-сепараторах, в которых одновременно происходит как смешение жидкостей, так и их сепарирование. Выделенный из культуральной жидкости методом экстракции продукт поступает на экстракцию, т. е. его переводят из органического растворителя в воду. Дальнейшее концентрирование антибиотика, его очистка и выделение осуществляются химическими методами.
Ионообменный метод
Ионообменный метод является одним из эффективных способов выделения биологически активных веществ из культуральной жидкости. Этот метод отличается рядом преимуществ перед другими методами: простота аппаратурного оформления многократное использование ионообменных смол, возможность осуществлении полной механизации и автоматизации технологического процесса, исключение контакта работающих с часто токсичными полупродуктами, работа с водными растворами без применения вредных органических растворителей. Ионообменный метод основан на способности ионообменных смол сорбировать биологически активные вещества, благодаря эквивалентному обмену между ионами вещества, находящегося в растворе, и ионами сорбента. Ионообменные смолы, или иониты, представляют собой синтетические высокомолекулярные органические вещества трехмерной структуры, практически нерастворимые в воде и органических растворителях. Иониты содержат обменные ионы, называемые подвижными или противоионами, которые связаны с противоположно заряженным ионом, называемым фиксированным или анкерным. Иониты с положительно заряженными противоионами называют катионитами. Иониты с отрицательно заряженными противоионами называют анионитами. Кроме того, существуют и амфотерные иониты, которые содержат катионо- и анионоименные группы, обладая, таким образом, двойственными функциями. При введении ионита в неорганическую или органическую жидкость происходит более или менее значительная сольватация противоионов и фиксированных ионов с одновременным увеличением объема, т. е. набухание полимера. Но трехмерная структура ионитов ограничивает их способность к набуханию. Набухший ионит можно сравнить с губкой, характеризующейся чередованием сгущений и разрежений. Через такую структуру, которую называют пространственной сеткой, осуществляется движение обменивающихся ионов. Ионит должен быть проникаем как для сорбируемых, так и для десорбируемых ионов. В соответствии со способом получения иониты подразделяют на полимеризационные и поликонденсационные. Как в тех, так и в других матрица состоит из длинных продольных цепей, соединенных между собой поперечными мостиками, называемыми химическими узлами. Продольные цепи могут механически переплетаться, образуя физические узлы. Увеличение или уменьшение числа химических и физических узлов влияет на размер микропор ионитов, а, следовательно, и на их проницаемость.
Основной характеристикой обменной способности ионита является полная обменная емкость выражаемая как число обменных групп в миллиграмм-эквивалентах (мг-экв.), приходящихся на 1 г ионита. В отличие от экстракционного метода, при котором целевой компонент переходит из одной жидкости в другую, сорбционный метод основан на массообмене между жидкой и твердой фазами. Ионообменное извлечение может быть осуществлено тремя способами: статическим, динамическим и хроматографическим.
Статический способ заключается в смешении и последующем разделении ионита и обрабатываемого раствора. Процесс проводится в емкостном аппарате, снабженном мешалкой для суспензирования ионита в растворе. По окончании сорбцииионит, содержащий целевой компонент, например антибиотик, отделяют от маточного раствора на фильтре, промывают водой и возвращают в аппарат. В аппарате проводят таким же образом извлечение антибиотика. Статический способ применяют главным образом в лабораторной практике. Наиболее распространенным при ионообменном выделении антибиотиков стал динамический способ. Он заключается в пропускании раствора через слой ионита в одном направлении. По мере движения раствор «обедняется» сорбируемыми ионами, а контактирует с активными (с точки зрения ионообменной способности) слоями ионита. При этом протекающий раствор уносит с собой продукты ионообменной реакции, т. е. вытесненные ионы. Благодаря этому достигается практически полное извлечение антибиотика из раствора и постепенное насыщение слоя ионита. Выделение антибиотика из сорбента в динамических условиях позволяет достичь полной десорбции антибиотика и получать высокоактивные (концентрированные) растворы. Ионообменная хроматография применяется преимущественно в исследовательских работах для более четкого отделения антибиотика от других соединении, сорбируемых ионитом.
Аппараты для ионного обмена
Основным аппаратом для осуществления динамического ионного обмена является ионитовый фильтр, представляющий собой вертикальный цилиндрический сосуд, заполненный ионитом, через слой которого протекает обрабатываемая жидкость. Фильтры изготавливаются из углеродистой стали, а также из винипласта, стекла, плексигласа. Так как высота фильтров обычно гораздо больше их диаметра, то их называют ионообменными колоннами. В производстве антибиотиков встречаются два типа ионообменных фильтров: закрытый (напорный) и открытый (безнапорный). Закрытый фильтр представляет собой герметичную конструкцию, рассчитанную на работу под напором пртекаюшей через него жидкости, т. е. на избыточное внутренние давление. У днища внутри фильтра устанавливается диск с отверстиями, в которые ввинчиваются колпачки. На диск загружается ионообменная смола. Колпачки имеют щелевидные прорези шириной 0,2 - 0,3 мм. Жидкость при движении в колоне сверху вниз проходит сквозь прорези, а зерна ионита, размеры которых превосходят ширину щели, задерживаются в колонне. В верхней части фильтра имеется устройство для распределения жидкости при движении ее сверху и отвода жидкости при промывке, когда промывная жидкость подается снизу. Распределительное устройство представляет собой крестовину, состоящую из винипластовых трубок-лучей с отверстиями, обеспечивающими равномерность поступления или отвода жидкости.
 Практика использования напорных фильтров с верхней подачей растворов выявила наличие в их работе ряда существенных недостатков, вызванных тем, что слой ионита в таком фильтре фактически неподвижен и сжат давлением нагнетаемой жидкости. Это приводит к слипанию частиц ионита, образованию каналов, через которые проходит значительная часть жидкости. Таким образом, не все зерна и не вся поверхность отдельных зерен участвуют в ионообменном процессе, что, естественно, уменьшает производительность колонны и снижает полноту извлечения. Кроме того, возникает опасность инфицирования фильтров микрофлорой в застойных участках слоя.
Практика использования напорных фильтров с верхней подачей растворов выявила наличие в их работе ряда существенных недостатков, вызванных тем, что слой ионита в таком фильтре фактически неподвижен и сжат давлением нагнетаемой жидкости. Это приводит к слипанию частиц ионита, образованию каналов, через которые проходит значительная часть жидкости. Таким образом, не все зерна и не вся поверхность отдельных зерен участвуют в ионообменном процессе, что, естественно, уменьшает производительность колонны и снижает полноту извлечения. Кроме того, возникает опасность инфицирования фильтров микрофлорой в застойных участках слоя.
| Рисунок 21 - Ионитовые фильтры: а - закрытый (напорный), б - открытый (безнапорный): 1- корпус фильтра; 2- распределительное устройство для жидкости; 3- ионит; 4- колпачки; 5- слой зернистого материала. |
Открытый фильтр не имеет этих недостатков. Нативный раствор подается в этом фильтре снизу со скоростью, при которой зерна ионита поддерживаются во взвешенном в жидкости состоянии (псевдоожиженный, или «кипящий» слой). При этом каждое зерно ионита омывается раствором со всех сторон и ионит используется более эффективно. Отвод из колонны жидкости, подаваемой снизу, осуществляется через патрубок. Верхняя, расширенная часть колонны предназначена для осаждения мелких частиц ионита под действием силы тяжести, т. е. выполняет функцию отстойника. Оседанию взвеси способствует уменьшение скорости потока при его расширении вo время движения через коническую часть осадителя и изменение направления шлака при переливе жидкости через борт в кольцевой карман. Частицы ионита, осевшие не в кармане, возвращаются в колонну через переливной патрубок.
Выделение продуктов метаболизма из биомассы клеток
Целевым продуктом микробиологического синтеза могут быть внутриклеточные биополимеры (белки, липиды, нуклеиновые кислоты), а также метаболиты (ферменты, антибиотики и т. д.). Некоторые из них можно выделить, не разрушая клеточной стенки, а для извлечения других необходимо провести предварительно дезинтеграцию (разрушение) клеточной оболочки.
Экстракция антибиотиков из мицелия представляет собой процесс извлечения целевого продукта из твердой фазы растворителем. Затем экстрагент с извлекаемым компонентом отделяется от твердой фазы. В качестве растворителей в производстве антибиотиков используют воду, водные растворы кислот или щелочей, органические растворители. Существует несколько способов проведения экстракции из твердой фазы: экстракция с перемешиванием, экстракция в неподвижном слое, экстракция одно- и многоступенчатая, прямоточная и противоточная. Экстракция с перемешиванием - наиболее простой способ извлечения антибиотика. Экстракцию с перемешиванием проводят в экстракторе, который представляет собой герметичный аппарат из нержавеющей стали с мешалкой. Аппарат приспособлен как для экстракции антибиотиков из твердой фазы, так и для последующего отделения экстракта от отработанного мицелия. Мицелий через люк загружают в экстрактор и туда же приливают растворитель из расчета 3 ч (масс.) растворителя на 1 ч (масс.) мицелия. Процесс проводят при комнатной температуре и постоянном перемешивании в течение 1 ч. После окончания экстракции полученный экстракт отфильтровывают от мицелия в сборник под давлением сжатого азота. Для осуществления фильтрования в днище экстрактора закреплена решетка, на которую натягивают фильтрующую ткань (бельтинг, бязь). С помощью специального приспособления днище может быть опущено для облегчения смены фильтрующего полотна. Оставшийся после фильтрования экстракта мицелий содержит еще значительное количество антибиотика. Чтобы извлечь его, проводят вторую экстракцию, для чего в экстрактор заливают экстрагент из расчета 2 ч (масс.) растворителя на 1 ч (масс.) мицелия, перемешивают в течение 1 ч и отфильтровывают экстракт от мицелия. Отработанный мицелий подвергают третьей экстракции, используя 1 ч (масс.) растворителя на 1 ч (масс.) мицелия, и отфильтровывают экстракт. Второй и третий экстракты объединяют с первым, если концентрации антибиотика в них достаточно высоки. При низких концентрациях антибиотика во втором и третьем экстрактах их используют в качестве экстрагентов для первой экстракции антибиотика из свежего мицелия, т. е. ведут экстракцию по принципу противотока. Экстракт, содержащий антибиотик, подвергают реэкстракции. Мицелий, остающийся на фильтре, продувают азотом от остатков растворителя и направляют на утилизацию. Для получения концентрированного экстракта применяют батарею из 2 - 3 и более последовательно соединенных колонн. Экстракция в батарее осуществляется по принципу противотока: в первую, т. е. головную колонну, где находится наиболее истощенный осадок антибиотика, подают свежий растворитель. Когда концентрация выходящего из этой колонны экстракта становится ниже допустимой, колонну отключают, а вместо нее к концу батареи присоединяют колонну со свежим осадком антибиотика. Таким образом, головным становится диффузор, бывший ранее вторым, общее же число экстракторов в батарее не меняется. Из отключенной колонны вынимают с помощью тали патроны со шламом и направляют их на разгрузку. Затем колонну заполняют патронами-вставками со свежим мицелием и подключают к батарее в качестве последнего аппарата. Экстракт, содержащий антибиотик, направляют на реэкстракцию.
Для выделения внутриклеточных антибиотиков проводят дезинтеграцию клеточных оболочек. Дезинтеграция может быть осуществлена химическими, биологическими или физическими способами. Химический способ дезинтеграции основан на действии химических peaгентов, которое приводит к деструкции упорядоченных структур клеточной стенки микроорганизмов. Обработка суспензии микроорганизмов щелочью, мочевиной, глицерином, аммиаком или пероксидом водорода повышает проницаемость клеточных стенок, благодаря чему биополимеры выводятся из клеток в раствор. Химические способы дезинтеграции пока не нашли широкого распространения в микробиологической промышленности, так как химические реагенты не только действуют на клеточную оболочку, но и могут вступать в реакции с компонентами клетки.
Биологические способы разрушения клеточной оболочки основаны на действии литических ферментов. Автолиз (или расщепление) клеточной стенки может происходить под действием или собственных внутриклеточных гидролитических ферментов, или действием ферментных препаратов. Процесс протекает в кислой среде при температуре 30 - 35 °С в течение нескольких часов. В результате образуется смесь продуктов гидролиза: аминокислоты, пептиды, полипептиды и т. д. Ферментативная дезинтеграция относится к наиболее мягким способам разрушения клеточной оболочки, однако она пока не получила широкого применения из-за сравнительно высокой стоимости ферментных препаратов.
Физическая дезинтеграция - это процесс механического воздействия на клетку, который сопровождается быстрым перемещением разрушаемого материала в зоне действия дезинтегрирующих сил. Процесс происходит при высоких скоростях в непрерывном режиме и может быть автоматизирован.
Клетки микроорганизмов могут быть разрушены также путем замораживания и оттаивания, истирания, экструзии, воздействия ультразвука и др. На основе этих процессов созданы установки, которые применяются при дезинтеграции различных видов микроорганизмов. В результате дезинтеграции клеточной биомассы внутриклеточные биополимеры оказываются в растворе, из которого их выделяют тем или иным способом, например экстракцией.
Выделение белковых веществ из сложной смеси дезинтегрантов клеток - очень трудоемкий и дорогостоящий процесс, который целесообразно применять в производстве только очень ценных биологически активных веществ.
Выделение жизнеспособных микроорганизмов
К этой группе относятся биопрепараты, в которых требуется сохранить жизнеспособность самих микроорганизмов или высокую биологическую активность их метаболитов (например, ферментов) до момента их применения. Число таких биопрепаратов непрерывно возрастает. К ним относятся хлебопекарные дрожжи, средства защиты растений, многие бактерии, вирусы, антибиотики, ферменты и т. д. Технология получения биопрепаратов на основе жизнеспособных микроорганизмов более сложная, чем получение препаратов, содержащих биологически активные продукты жизнедеятельности микроорганизмов. Получение биопрепаратов, содержащих жизнеспособные микроорганизмы, основано на способности микроорганизмов при обезвоживании прекращать заметную жизнедеятельность на длительное время и возобновлять ее при последующем обводнении. Такое состояние, когда метаболизм обратимо заторможен или приостановлен, называют анабиозом. Задача получения биопрепаратов, содержащих жизнеспособные микроорганизмы, на первый взгляд, кажется простой. Микроорганизмы, выделенные из культуральной жидкости, необходимо высушить до определенной влажности, в некоторых случаях совместить с наполнителем или стабилизирующими добавками и расфасовать, в удобную для хранения и применения тару. Однако во время обезвоживания биомассы в клетках происходят существенные изменения. Эти изменения могут привести к образованию новых нежелательных соединений, к инактивации биологически активных веществ и утрате жизнеспособности клеток. Вода в концентрате биомассы находится как в свободном, так и в связанном состоянии. При сушке удаляется внеклеточная и внутриклеточная вода. Причем, если удаление из биомассы внеклеточной воды протекает сравнительно легко, то отделение воды, связанной с компонентами биомассы, требует значительно больше энергии и необходимо повышать температуру сушки, которая ограничивается термостойкостью микроорганизмов. Главное требование, предъявляемое к технологии обезвоживания микроорганизмов - это сохранение их жизнеспособности, Поскольку все микроорганизмы являются термолабильными, их сушку следует проводить в мягком режиме, т. е. при невысокой температуре и небольшой продолжительности.
|
Дата добавления: 2014-01-04; Просмотров: 2367; Нарушение авторских прав?; Мы поможем в написании вашей работы!