
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование металлорганических соединений
Синтез нитросоединений
Легче всего реакция протекает с азотистокислым серебром, хуже с калиевыми или литиевыми солями:

14.2.6 Синтез аминов
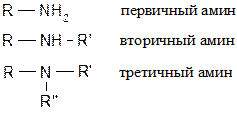
Первичные амины получают из алкилгалогенидов и аммиака:

Первичный амин из-за (+I)-эффекта алкильных групп нуклеафильнее аммиака, поэтому реакция галогенпроизводного с первичным амином пойдет легче, чем с аммиаком:
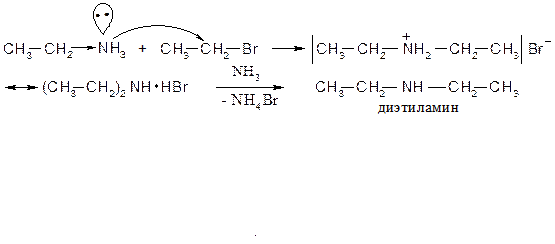
Аналогично получают третичный амин.
Третичные амины могут также участвовать в реакции с галогенпроизводными:
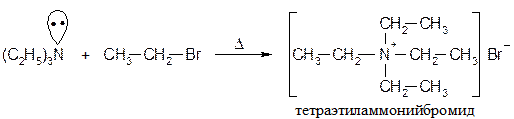
Алкиламмониевые соли являются поверхностно-активными веществами. В некоторых случаях обладают антисептической биологической активностью и уничтожают запахи. Используются в качестве катализаторов в гетерогенных реакциях (способствуют реакции межфазного переноса).
Четвертичные аммониевые соли реагируют со щелочами, давая четвертичные аммониевые основания: [R4N]+OH–. Подобные соединения являются супероснованиями (высокая степень диссоциации), используются для создания суперосновных сред.
Pb(C2H5)4 - тетраэтилсвинец
С2H5-Zn-C2H5 - диэтилцинк
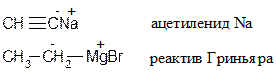
Металлорганические соединения имеют полярную связь C-Me:
(80 % - ионная,20%--ковалентная)
На углероде значительный отрицательный заряд, поэтому металлорганические соединения крайне реакционоспособны. С водой, спиртами и любыми кислотами они разрушаются, образуя алканы:
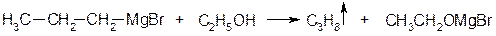
На основе металлорганических соединений можно получить:
1) Карбоновые кислоты:

2) Карбонильные соединения

3) Спирты
Вторичные и третичные спирты получают с карбонильными соединениями. Первичные спирты только с муравьиным альдегидом или окисью этилена.

СОДЕРЖАНИЕ
1 Специфика органической химии. 1
2 Теория гибридизации. 1
2.1 Типы гибридных орбиталей. 1
2.2 Первое валентное состояние атома углерода Гибридизация sp3 2
2.3 Второе валентное состояние атома углерода Гибридидизация sp2 3
2.4 Третье валентное состояние атома углерода Гибридизация sp. 4
3 Типы связей в органической химии. 6
3.1 Ковалентные связи. 6
3.1.1 Индукционный эффект (σ-эффект) [±I] 7
3.1.2 Мезомерный эффект (эффект сопряжения) [±M] 7
Понятие сопряжения. 7
Эффекты сопряжения. 8
Правило Морковникова. 8
3.2 Донорно-акцепторные связи. Семиполярные связи. 9
3.3 Водородная связь. 10
4 Номенклатура органических соединений. 10
4.1 Тривиальная. 10
4.2 Рациональная номенклатура. 10
4.2.1 Алканы.. 10
4.2.2 Алкены.. 12
4.2.3 Диены.. 12
4.2.4 Алкины.. 12
4.2.5 Спирты.. 13
4.2.6 Альдегиды.. 13
4.2.7 Карбоновые кислоты.. 13
4.2.8 Кетоны.. 14
4.2.9 Простые эфиры.. 14
4.2.10 Амины.. 14
4.2.11 Основные заместители - производные от ароматических соединений. 14
4.3 Номенклатура ИЮПАК (JUPAC) 15
4.3.1 Насыщенные углеводороды. Карбоциклические соединения. 15
4.3.2 Названия ненасыщенных и ароматических углеводородов. 16
4.3.3 Номенклатура гетероциклических соединений. 20
4.3.4 Номенклатура ИЮПАК для производных различных классов органических соединений 21
5 Изомерия органических соединений. 25
5.1 Структурная изомерия. 25
5.2 Изомерия положения. 25
5.3 Геометрическая изомерия (зеркальная, цис- транс- изомерия) 26
5.4 Оптическая изомерия. 28
Устройство поляриметра. 29
5.4.1 Диастереомеры.. 30
5.4.2 Номенклатура стереоизомеров. 31
Номенклатура Кана, Ингольда, Прелога (КИП) 32
5.5 Номенклатура стереоизомеров Потапова В.М., Терентьева А.П. и сотрудников. 34
6 Классификация органических реакций и реагентов. 36
6.1 По способу разрыва (образования) химических связей. 36
6.2 Классификация реакций по типу превращений в органических веществах. 37
6.2.1 Реакции замещения [S] 37
6.2.2 Реакции присоединения [A] 37
6.2.3 Реакции элиминирования (отщепления) [E] 38
6.2.4 Реакции внедрения. 38
6.2.5 Реакции перегруппировки. 38
6.2.6 Реакции деградации (распада) 38
7 Строение основных частиц в органической химии. 39
7.1 Карбоанионы (карбанионы) 39
7.2 Карбокатионы.. 39
7.3 Свободные радикалы.. 40
7.4 Понятие о граничных структурах. 41
8 Алканы (парафины) 42
8.1 Физические свойства. 42
8.2 Промышленная переработка алканов (нефти) 42
8.3 Некоторые лабораторные способы получения алканов. 42
8.3.1 Восстановление галогенпроизводных углеводородов. 42
8.3.2 Получение алканов реакцией Вюрца. 43
8.3.3 Гидрирование алкенов, диенов и алкинов. 43
8.3.4 Восстановление галогенпроизводных водородом на катализаторах или натрием в спирте 43
8.3.5 Реакция Кольбе. 43
8.3.6 Синтезы с использованием диазопроизводных. 44
8.4 Реакции алканов. 44
8.4.1 Взаимодействие с галогенами. 44
8.4.2 Нитрование алканов. 46
8.4.3 Сульфирование алканов. 46
8.4.4 Окисление алканов. 46
9 Циклоалканы.. 46
9.1 Основные способы получения. 47
9.1.1 Гидрирование непредельных циклических и ароматических углеводородов. 47
9.1.2 Реакции расширения цикла (внедрения) 47
9.1.3 Реакции циклизации. 47
9.1.4 Строение циклических углеводородов. 48
9.1.5 Строение малых циклов (циклопропан, циклобутан) 48
9.1.6 Основные реакции средних циклов (циклопентан, циклогексан) 49
10 Алкены (этилены) 50
10.1 Строение алкенов. 50
10.2 Получение алкенов. 50
10.3 Лабораторные методы получения алкенов. 51
10.3.1 Дегидрогалогенирование галогенпроизводных (по правилу Зайцева) 51
Некоторые закономерности реакции отщепления. 52
10.3.2 Дегидратация спиртов (отщепление воды) 53
10.3.3 Дегалогенирование дигалогенпроизводных. 54
10.3.4 Восстановление алкинов (ацетиленов) 54
10.3.5 Расщепление четвертичных аммонийных солей по Гофману. 55
10.3.6 Термическое расщепление сложных эфиров по Коупу. 55
10.3.7 Реакция Фиттига. 55
10.4 Химические свойства алкенов. 55
10.4.1 Гидрирование (восстановление) 55
Пространственные эффекты гидрирования. 56
10.4.2 Присоединение галогенов. 56
10.4.3 Присоединение H-кислотных соединений (HX) и галогенов. 57
Отклонения от правила Морковникова. 57
10.4.4 Каталитическое присоединение воды.. 58
10.4.5 Присоединение спиртов. 58
10.4.6 Присоединение формальдегида. 58
10.4.7 Реакции теломеризации и полимеризации. 59
10.4.8 Димеризация изобутилена в кислой среде. 60
10.4.9 Алкилирование ароматических соединений в кислой среде. 60
10.4.10 Реакции окисления алкенов. 60
10.4.11 Галогенирование в α-положение. 61
10.4.12 Реакции циклоприсоединения. 62
11 Диены.. 62
Виды сопряженных диенов. 63
11.1 Способы получения сопряженных диенов. 63
11.2 Строение диенов. 65
11.3 Химические свойства диенов. 65
11.3.1 Реакции присоединения. 65
Механизм реакции [AE] для сопряженных диенов. 66
Некоторые аспекты применения сопряженных диенов. 67
12 Алкины (ацетилены) 69
12.1 Способы получения ацетилена. 69
12.2 Некоторые способы получения гомологов ацетилена. 69
12.3 Общая характеристика реакционной способности ацетиленов. 71
12.4 Свойства ацетилена. 71
12.5 Химические свойства. 72
12.5.1 Реакции присоединения. 72
Реакции нуклеофильного присоединения к ацетиленам.. 73
12.5.2 Некоторые свойства виниловых эфиров. 73
13 Ароматические углеводороды.. 76
13.1 Признаки ароматичности. 76
13.2 Направление реакций ароматических соединений. 78
Ориентация при электрофильном замещение (SEAr) 81
Мнемоническое правило смещения электронной плотности под действием заместителя в ядре 81
13.3 Нуклеофильное замещение в ароматических системах (SNAr) 82
Механизм реакции SNAr 83
14 Галогенпроизводные углеводородов. 83
14.1 Методы получения галогенпроизводных. 83
14.1.1 Замещение водорода на галоген в условиях радикальных процессов (прямое галогенирование алканов) 83
14.1.2 Галогенирование непредельных углеводородов. 84
14.1.3 Галогенирование ароматических соединений. 84
14.1.4 Получение ароматических галогенпроизводных из анилина и его производных. 85
14.1.5 Получение галогенпроизводных из эфиров сульфокислот. 85
14.1.6 Обмен галогена на галоген. 85
14.1.7 Замещение гидроксильных групп спиртов. 85
Закономерности реакций нуклеофильного замещения у насыщенного атома водорода. 86
14.1.8 Получение галогенпроизводных из непредельных углеводородов. 88
Общая характеристика реакционной способности галогенпроизводных. 89
14.2 Важнейшие реакции галогенпроизводных. 90
14.2.1 Реакции гидролиза. 91
14.2.2 Образование простых эфиров. 91
14.2.3 Синтез меркаптанов и сульфидов. 92
14.2.4 Образование нитрилов карбоновых кислот. 92
14.2.5 Синтез нитросоединений. 92
14.2.6 Синтез аминов. 92
14.2.7 Образование металлорганических соединений. 93
СОДЕРЖАНИЕ.. 95
|
Дата добавления: 2013-12-12; Просмотров: 917; Нарушение авторских прав?; Мы поможем в написании вашей работы!