
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1.Основные закономерности ХТП
Раздел 1. Основы химической технологии
Введение
| Цель, объем и содержание дисциплины. Литература по дисциплине. Задачи дисциплины. Особенности химической технологии как науки и ее связь с другими науками. Основные понятия и определения. Роль химической промышленности в экономике страны. |
Развитие человеческого общества происходит по многим направлениям, определяющим потребности общества в целом и каждого человека в отдельности. Из многих направлений в настоящем учебнике выделена сфера прикладной деятельности - технология. Это научно-производственная деятельность, цель которой - обеспечение человеческого общества и каждого человека средствами производства и потребления.
Технология представляет собой множество процессов и методов переработки сырья в продукты потребления и средства производства, состоящее из трех основных компонентов: природного (ПрК), научно-технического (НТК) и личностно-социального (ЛСК).
Термин «технология» происходит от греческого τεχυε (технэ) - искусство, ремесло и λογοσ (логос) - понятие, учение, т.е. это совокупность знаний о способах и средствах проведения производственных процессов. В соответствии с характером проводимых процессов можно выделить два вида технологии: механическую и химическую.
Механическая технология изменяет физические свойства, форму и внешний вид сырья, химическая - состав сырья, его химические и физико-химические свойства или структуру. Химическая технология - объективная общность природного, научно-технического и личностно-социального компонентов, представленная множеством процессов и методов переработки сырья при коренном изменении его состава и физико-химических свойств или структуры, связанных прямыми и обратными связями материально, энергетически и информационно для получения средств производства и средств потребления.
Такое деление в известной степени условно, так как часто при изменении вида материала меняются его состав и химические свойства. Химические процессы в свою очередь всегда сопровождаются механическими.
Возникновение науки о химической технологии относится к концу XVIII века, когда после стремительного развития текстильной промышленности в последней трети века возникла потребность в химических продуктах - серной кислоте, соде, хлоре.
Первоначально наука о химической технологии представляла собой собрание рецептов и описание немногих существовавших в то время химических производств без обоснования выбранного способа производства. Затем в нее были включены описания всех производств, в которых осуществлялись химические превращения. Кроме описания технологических приемов делались попытки проанализировать некоторые физико-химические явления.
В России изучение химической технологии относится к началу XIX века. Проф. Ф.А. Денисовым (Московский университет) было издано «Пространное руководство к общей технологии или к познанию всех работ, средств, орудий и машин, употребляемых в разных технических искусствах». В руководстве в отдельную часть выделена «Общая технология»; вторая часть посвящена описанию отдельных производств «от начала до конца».
Из химической технологии в специальные науки выделены производства, в которых специфичные для них методы имели значение наряду с общими для всех химико-технологических, например, металлургия, производство строительных материалов (цемент, стекло, керамика), текстильные отрасли (отбелка и крашение материалов), а также нефтепереработка (за исключением подготовки сырья для химических производств).
Общие закономерности для названных специальных наук по-прежнему сосредоточены в науке о химической технологии, которая в настоящее время называется общей химической технологией. Это направление было развито в начале XX века проф. А.К. Крупским (Петербургский технологический институт) и его последователями.
Больedeшой вклад в развитие науки о химической технологии внесли акад. С. И. Вольфкович, проф. И.П. Мухленов, проф. А.Г. Амелин и их школы, создавшие фундаментальные руководства, на которых учились многие поколения отечественных инженеров-химиков и которые сохранили свое значение до настоящего времени.
К 30-м годам XX столетия был накоплен большой фактический материал по химической технологии, и из нее в виде отдельной дисциплины были выделены физические процессы, общие для многих технологических методов (транспортировка веществ, выпаривание, фильтрование и т.д.), в основе которых лежат закономерности физики. В них включены гидродинамические, тепловые, диффузионные и механические процессы. Во второй половине XX века в отдельную дисциплину выделены контрольно-измерительные приборы и автоматизация химических производств.
В настоящее время химическая технология представляет собой блок наук, изучающих процессы с химическими и физико-химическими превращениями, имеющие общие закономерности на основе химической термодинамики и кинетики.
В ходе исследований развития прикладной (промышленной) деятельности (с 1909 г. по настоящее время) акад. И.В. Петрянов-Соколов доказал экспоненциальный характер использования природных ресурсов, в том числе и при развитии химической промышленности, как по объему, так и по ассортименту средств потребления и средств производства. В качестве иллюстрации представлена динамика вовлечения в деятельность человека элементов Периодической системы Д.И. Менделеева за несколько столетий добычи горных пород. До XVI-XVII веков человеческое общество довольствовалось 18 химическими элементами; к XVII веку их требовалось уже 25, к началу XVIII века - 29, в XIX веке - 47, к началу XX века - 54, а в середине XX века - 88, не считая 11 трансурановых элементов.
При современном уровне производства на земном шаре добывается ежегодно около 100 млрд. т горных пород. К концу XX века эта цифра, по некоторым прогнозам, может достичь 600 млрд. т. Растущие потребности в некоторых материалах на одного человека в год до конца XX века (в кг) также свидетельствуют о высоких темпах развития химической промышленности:
| 1970 г. | 1980 г. | 1990 г. | 2000 г. | |
| Черные металлы | ||||
| Цветные металлы | ||||
| Всего | ||||
| Синтетические материалы | ||||
| (пластмассы, синтетический | ||||
| каучук, синтетические волокна) | ||||
| Натуральный каучук | 0,9 | 0,5 | 0,5 | 0,5 |
| Натуральные волокна | ||||
| Всего | 37,9 | 75,5 | 199,5 | 583,5 |
Потребность в удобрениях в странах СНГ показана ниже (в тыс. т 100% полезного вещества):
| 1985 г. | 1990 г. | 1995 г. | 2000 г. | |
| Азотные N2 | ||||
| Калийные К2О | ||||
| Фосфорные Р2О5 | ||||
| Всего |
При экспоненциальном нарастании потребности в средствах потребления и производства наблюдается и рост числа химических
| Условия ведения химических производственных процессов. Степень приближенности теоретических расчетов к практическим возможностям. Важнейшие поправочные условия: подготовленность сырья, фазовые состояния, обеспечение контакта, аппаратурные ограничения, экономические соображения. Обратимые и необратимые процессы. Равновесие в обратимых процессов. Принцип ЛеШателье в химических обратимых процессах. Константа равновесия как количественная характеристика равновесия. Скорость гомогенных и гетерогенных химикотехнологических процессов. Скорости реакций и диффузионных стадий процессов. Способы определения скорости процессов. Основные формулы скорости процесса. Основные показатели химического производства: расходные коэффициенты, качество готового продукта, производительность и мощность аппаратуры, интенсивность процесса, производительность труда, себестоимость продукта. Принципы составления материального и энергетического балансов. |
Технология (наука о ремесле) изучает способы и процессы переработки продуктов природы (сырья) в предметы потребления и средства производства.
Способ переработки есть совокупность всех операций, которые проходит сырье до получения из него готового продукта.
Способ переработки (производства) есть описание операций, протекающих в соответствующих машинах и аппаратах. Такое описание называют технологической схемой.
В основе химической технологии лежат химические, физические и физико - химические закономерности, т.е. закономерности общей, органической и физической химии, физики, механики и других химических и обще инженерных дисциплин.
Химико-технологический процесс представляет собой сумму
взаимосвязанных элементарных процессов:
1. Подвод реагирующих компонентов в зону реакции;
2. Химические реакции;
3. Отвод полученный продуктов из зоны реакции.
Подвод реагирующих компонентов в зону реакции совершается путем молекулярной диффузии или путем конвекции.
При интенсивном перемешивании компонентов конвективный перенос называют турбулентной диффузией.
Химическая технология чаще всего связана с многофазным системами. Система есть группа веществ, находящихся во взаимодействии. Фаза- совокупность однородных частей системы, одинаковых по составу, химическим и физическим свойства и ограниченных от других частей системы поверхностью раздела. В многофазных системах подвод реагирующих компонентов в зону реакции может осуществляться абсорбцией, адсорбцией, десорбцией, конденсацией паров, плавлением твердых веществ, испарением, выпаркой. Эта стадия перехода компонента из одной фазы в другую часто является наиболее медленным этапом химико-технологического процесса, и определяет общую его скорость.
Химические реакции составляют основу химико-технологического процесса.
Через ряд последовательных (иногда параллельных) химических реакций образуется готовый (основной) продукт и побочные продукты, а также отходы производства. Химико-технологический процесс усложняется в силу того, что в исходном сырье неизбежно есть примеси, которые и приводят к образованию побочных продуктов. В производственных расчетах обычно учитываются только те реакции, которые имеют определяющее влияние на качество и количество полученных основных продуктов.
Отвод полученных продуктов из. зоны осуществляется также как и подвод реагирующих компонентов, т.е. диффузией и конвекцией, которые в основном определяют переход, вещества из одной фазы в другую.
Примером сложности, многостадийности химико-технологических процессов является реакция С + O2 → CO2 + O
 ← O2
← O2
или горение колчедана
4 FeS2 +11O2 → 8 SO2 +2FeO3 +Q
Чтобы произошло химическое взаимодействие между колчеданом и кислородом, необходимо прежде всего к поверхности колчедана подвести кислород, а после того, как произошла реакция, отвести образовавшийся SO2 с поверхности колчедана. Обжиг колчедана будет распространяться внутрь, при этом кислород при проникновении к не сгоревшему колчедану FeS2 будет встречать не своем пути слой огарка, образовавшегося на поверхности колчедана, и слой инертного газа N2, содержащегося в воздухе. Образовавшийся SO2 должен преодолеть это сопротивление при выходе в объем газа. Эти процессы медленного проникновения одного веще в другое и называется диффузией.
Суммарная скорость процесса определяется скоростью вышеперечисленных элементарных стадий, которые протекают с различными скоростями. Поэтому общая скорость будет лимитироваться скоростью наиболее медленной стадии. Если наиболее медленно протекает сама химическая реакция, то процесс протекает в кинетической области.
Для ускорения таких процессов необходимо изменить факторы, влияющие на скорость химической реакции (концентрация реагирующих компонентов, температура, давление, применение катализаторов и т.д.). Если общую скорость лимитирует стадия подвода реагирующих компонентов или отвода продуктов реакции, то процесс протекает в диффузионной области. Для ускорения таких процессов стремятся увеличить диффузию (перемешивание, гомогенизация системы, повышениеt◦, и т.д.).
Знание основных закономерностей химической технологии дает возможность, установить оптимальные условия процесса, проводить его наиболее эффективно с максимальным выходом, обеспечить высокое качество продукции.
КЛАССИФИКАЦИЯ ХИМИКО - ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Технологический режим есть совокупность основных параметров, влияющих на скорость процесса, выход и качество продукции. К основным параметрам относятся: температура, давление, применение катализатора, концентрация реагирующих веществ, способ и степень перемешивания реагентов.
Оптимальному значению параметров технологического процесса соответствует максимальная производительность аппаратов и наибольшая производительность труда. Поэтому в основу классификации химико-технологических процессов положены характер и значение основных параметров режима, определяющих технологический процесс.
На конструкцию аппаратов и скорость процессов сильно влияют способ и степень перемешивания реагентов, что в свою очередь зависит от агрегатного состояния реагирующих веществ. Поэтому химико-технологические процессы классифицируют прежде всего по агрегатному (фазовому) состоянию реагирующих веществ. По этому принципу технологические процессы делятся на:
I) Гомогенные (однородные) - когда реагирующие вещества находятся в какой-либо одной -фазе: газовой (Г), жидкой (Ж).
2) Гетерогенные (неоднородные), в основе которых системы из двух и больше количества фаз. Это: Г-Ж; Г-Т; Ж-Ж. (несмешивающиеся жидкости); Ж – Т; Т - Т. На практике наиболее часто встречаются Г-Ж; Г - Т; Ж - Т. Нередки и многофазные системы: Г-Ж-Т;Г-Т-T и т. д.
Гетерогенные процессы наиболее распространены. Как правило, гетерогенный этап процесса (массообмен) имеет диффузионный характер, а химическая реакция происходит гомогенно в газовой или жидкой фазе. Однако, в ряде случаев протекают гетерогенные реакции на границе Г-Ж; Г-Т; Ж-Т, которые и определяют общую скорость процесса.
По значениям других параметров технологического режима процессы можно разделить по наиболее важным и характерным параметрам:
1. Низкотемпературные некаталитические;
2. Высокотемпературные;
3. Каталитические;
4 Электрохимические.
Химические превращения веществ сопровождаются в той или иной степени тепловыми процессами. Поэтому процессы делят на:
1) экзотермические,- протекающие с выделением тепла;
2) эндотермические, - протекающие с поглощением тепла.
Кроме того, технологические процессы делят на:
1) обратимые;
2) необратимые.
В результате исторически сложившейся целесообразности управления производством и его специализации все отрасли производства, в основе которых лежат химические процессы, по техническому принципу делятся на группы:
производство неорганических веществ
- кислоты, соли, щелочи (основные химические производства),
- тонкие неорганические препараты,
- электрохимические (CI, H2 и др.),
- металлургия,
- силикаты, вяжущие вещества,
- краски, пигменты.
производство органических веществ
- основной органический синтез, (мономеры, альдегиды, спирты,
кислоты, растворители и т.д.),
- тонкий органический синтез (краситеди, душистые веществ
химикаты, лекарственные вещества и т.д.),
- производство высокомолекулярных веществ,
- переработка жидкого и твердого топлива,
- производства пищевых продуктов,
- биохимические производства.
Однако, деление процессов на органические и неорганические устарело, ввиду общности процессов и аппаратов, отсутствия точной границы между органическими и неорганическими веществами.
РАВНОВЕСИЕ В ТЕХНОЛОГИЧЕСКИХ
ПРОЦЕССАХ
Теоретически все реакции обратимы, т.е. могут протекать как в прямом, так и в обратном направлениях в зависимости от условий. Однако, во многих из них равновесие смещено полностью в сторону продуктов реакции и обратная реакция практически не протекает. Поэтому процессы делят на обратимые и необратимые
Обратимыми называются реакции, которые в рассматриваемых условиях могут протекать как в прямом, так и в обратном направлениях.
Химическим равновесием называется такое состояние системы, когда скорости прямой и обратной реакций равны, т.е. концентрации веществ не будут изменяться.
Ни условия равновесия наибольшее влияние оказывают изменения концентрации, температуры, давления.
Направления изменений в системе, которые могут быть вызваны перечисленными условиями, в общей форме определяются принципе Ле-Шателье:
В физико-химической системе, выведенной из состояния равновесия, происходят изменения, направленные к ослаблению воздействий выводящих систему из равновесия.
Рассмотрим применение принципа Ле-Шаталье на примере
реакции:
mA + nB ↔ pD + Q (I),
где: m, n, p - стехиометрические коэффициенты;
Q - тепловой эффект реакции.
Принимаем, что реакция протекает гомогенно (в газовой фазе), а, также, что m+n > р, т.е. реакция идет с уменьшением объема.
Примером такого типа реакций может служить синтез аммиака
3 Н2 + N2 = 2NН3 + Q
Для сдвига равновесия вправо, т.е. для повышения количеств продукта D, в соответствии с принципом Ле-Шателье необходимо понижать температуру, повышать давление, а также понижать концентрацию продукта D и повышать концентрацию исходных веществ А и В.
Согласно основному закону химической кинетики скорость прямой реакции будет:
→
U1 = к1 [А]m • [B]n
[А] и [B] -мольные концентрации (или парциальные давления) реагирующих компонентов;
к1 - константа скорости реакции, значение которой зависит от природы реагирующих веществ и температуры.
Скорость обратной реакции будет:
←
U2 = к2 • [D]p
По мере того, как в ходе реакции концентрация веществ А и B убывает, то скорость прямой реакции уменьшается. Увеличение концентрации вещества D в результате прямой реакции приводит к возрастанию скорости обратной реакции U2 что приведет к уравниванию скоростей прямой и обратной реакций.
→ ←
U1 = U2 или
к1 [А*]m • [B*]n = к2 • [D*]p, откуда
К=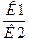
К - константа равновесия данной реакции;
[А*], [B*],[D*]- равновесные концентрации (или парциальные давления) реагирующих веществ и продуктов реакции.
|
|
Дата добавления: 2013-12-11; Просмотров: 845; Нарушение авторских прав?; Мы поможем в написании вашей работы!