
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные эффекты заместителей
Примеры небензоидных ароматических соединений
Примеры циклических систем, имеющих p,p-сопряжение
ББК
УДК
| ISBN 978-985-496-906-0 | © Павловский, Н.Д., 2011 © УО «ГрГМУ», 2011 |
 |
Лекция № 1
Предмет и задачи биоорганической химии. Взаимное влияние атомов и способы его передачи в органических молекулах. Сопряженные системы, ароматичность, электронные эффекты заместителей
Биоорганическая химия изучает связь между строением органических веществ и их биологическими функциями, используя методы органической и физической химии, а также физики и математики. Как самостоятельная наука, биоорганическая химия сформировалась во второй половине ХХ века на стыке биохимии и органической химии, на основе традиционной химии природных соединений. Объектами изучения являются биологически важные природные и синтетические соединения, главным образом биополимеры, а также витамины, гормоны, антибиотики, природные феромоны и сигнальные вещества, биологически активные вещества растительного происхождения, внутриклеточные регуляторы, а также синтетические регуляторы биологических процессов – лекарственные препараты, пестициды, инсектициды и другие соединения.
К основным задачам биоорганической химии относятся:
1. Разработка методов выделения и очистки природных соединений.
2. Определение строения и конфигурации изучаемого соединения.
3. Разработка методов синтеза как самих природных биологически важных веществ, так и их аналогов.
4. Изучение зависимости биологического действия от строения.
5. Выяснение химизма взаимодействия биологически активного вещества с живой клеткой или с ее компонентами.
Биоорганическая химия тесно связана с практическими задачами медицины и сельского хозяйства (получение витаминов, гормонов, антибиотиков, стимуляторов роста растений, регуляторов поведения насекомых и животных), химической, пищевой и микробиологической промышленности.
Сопряженные системы, виды сопряжения
Сопряженными системами называются соединения, в которых есть чередование двойных и ординарных связей. Простейшим примером такой системы является молекула бутадиена-1,3. Из структурной формулы видно, что в молекуле содержатся одна ординарная и две двойные связи углерод-углерод, которые должны иметь длины связей, соответственно, 0,153 нм и 0,132 нм, что характерно для длин ординарной и двойной связей углерод-углерод в алканах и алкенах. Физическими методами исследований было установлено, что длины связей между атомами С1 и С2, а также между С3 и С4 равны 0,135 нм, а длина связи между атомами С2 и С3 равна 0, 146 нм, молекула плоская, углы между связями равны 120°. Эти особенности объясняются возникновением сопряженной системы. Атомные орбитали всех атомов углерода в молекуле бутадиена-1,3 находятся в состоянии sp2-гибридизации, в результате которой каждый из них имеет три гибридные орбитали, лежащие в одной плоскости под углом 120° и одну негибридную р-орбиталь, располагающуюся перпендикулярно этой плоскости.
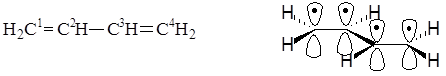
Пространственное строение бутадиена-1,3
Так как молекула имеет плоскую конфигурацию, то все s-связи, образованные с участием гибридных орбиталей, лежат в одной плоскости, а негибридные р-орбитали расположены перпендикулярно плоскости молекулы и параллельно между собой. Образование p-связей между атомами С1 и С2 и между атомами С3 и С4 происходит за счет двукратного перекрывания р-орбиталей с обеих сторон относительно плоскости молекулы, но так как все р-орбитали параллельны, то в молекуле имеет место дополнительное взаимодействие – перекрывание р-орбиталей между атомами С2 и С3, сопровождающееся выделением энергии, которая называется энергией сопряжения. В результате этого дополнительного перекрывания происходит перераспределение p-электронной плотности в молекуле и возникает делокализованная (сопряженная) p-система. При этом между атомами С1 и С2, а также С3 и С4 p-электронная плотность уменьшается, что приводит к увеличению длины этих связей в сравнении с длиной двойной связи С=С в алкенах, а между атомами С2 и С3 – p-электронная плотность увеличивается, что приводит к уменьшению длины связи в сравнении с длинами ординарных связей С-С в алканах.
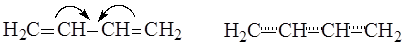
Делокализация p-электронной плотности в бутадиене-1,3
В реальной молекуле бутадиена-1,3 нет двойных или ординарных связей, все четыре р-электрона делокализованы по всей системе сопряжения, охватывающей углеродный скелет.
Таким образом, под термином сопряжение понимают делокализацию (перераспределение) p-электронной плотности в молекуле, приводящую к изменению длин связей и увеличению ее устойчивости за счет выделения энергии. Различают два типа сопряжения: p,p- и p,p-сопряжение, которые могут возникать как в циклических, так и ациклических молекулах.
p,p-Сопряжение возникает, если в сопряжении участвуют р-орбитали, образующие p-связи. В рассмотренной выше молекуле бутадиена-1,3 в сопряжении участвовали четыре электрона атомов углерода, расположенные на р-орбиталях, образующих p-связи, таким образом, можно сделать вывод о том, что в этом случае имеет место p,p-сопряжение.
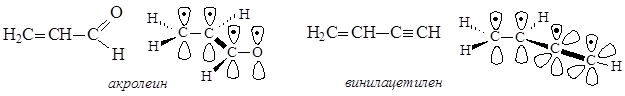
Примеры систем, имеющих p,p-сопряжение
В молекулах акролеина и винилацетилена сопряженная система возникает при участии четырех р-орбиталей, на которых находятся четыре электрона. В акролеине в p,p-сопряжении задействованы три р-орбитали атомов от трех атомов углерода, находящихся в sp2-гибридизации, и р-орбиталь атома кислорода. В винилацетилене в p,p-сопряжении участвуют две р-орбитали от двух атомов углерода, находящихся в sp2-гибридизации, и две р-орбитали от двух атомов углерода, находящихся в sp-гибридизации.
p,p-Сопряжение может быть и в циклических молекулах.
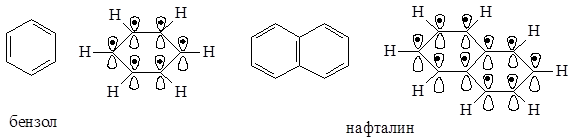
В молекуле бензола в p,p-сопряжении участвуют шесть р-орбиталей от шести атомов углерода, находящихся в sp2-гибридизации, на которых делокализуются шесть электронов. В молекуле нафталина в p,p-сопряжении участвуют десять р-орбиталей с десятью электронами.
р,p-Сопряжение возникает, если в сопряжение с р-орбиталями, образующими p-связи, вступает р-орбиталь, не участвующая в образовании связей, причем эта р-орбиталь может быть вакантной или на ней могут находиться один или два электрона.
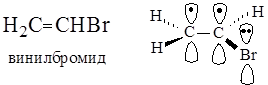
В молекуле винилбромида в р,p-сопряжении участвуют две р-орбитали атомов углерода, образующие p-связь, и р-орбиталь атома брома, не участвующая в образовании p-связи. Таким образом, в молекуле винилбромида на трех р-орбиталях делокализуются четыре электрона.
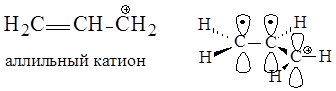
В аллильном катионе в р,p-сопряжении участвуют две р-орбитали атомов углерода, образующие p-связь, и вакантная р-орбиталь атома углерода, несущего положительный заряд. На трех р-орбиталях делокализуются два электрона и положительный заряд.
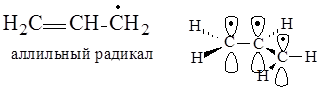
В аллильном радикале в создании сопряженной системы участвуют две р-орбитали, образующие p-связь, и р-орбиталь sp2-гибридизированного атома углерода, имеющая неспаренный электрон. На трех р-орбиталях делокализуются три электрона.
Как и p,p-сопряжение, р,p-сопряжение может иметь место в циклических системах.
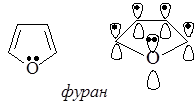
В молекуле фурана р-орбиталь атома кислорода, несущая неподеленную пару электронов, вступает в сопряжение внутри цикла с четырьмя р-орбиталями атомов углерода, образующими p–связи. В итоге возникает сопряженная система, в которой на пяти р-орбиталях делокализованы шесть электронов.

В молекуле фенола р-орбиталь атома кислорода, имеющая неподеленную пару электронов, вступает в р,p-сопряжение с р-орбиталью атома углерода, которая участвует в p,p-сопряжении внутри цикла. В этом случае возникает сопряженная система, в которой на семи р-орбиталях делокализованы восемь электронов.
Степень термодинамической устойчивости молекул характеризуется энергией сопряжения. Энергия сопряжения (энергия делокализации) – это та часть энергии, которую молекула теряет в результате сопряжения. Чем больше энергия сопряжения, тем стабильнее сопряженная система. Один из способов определения этой величины состоит в сравнении теплоты гидрирования бензола с ее расчетным значением, основанным на предположении о том, что бензол содержит три изолированные двойные связи:
| Теплота гидрирования циклогесена | -120 кДж/моль |
| Рассчитанная величина для бензола | 3× (-120) = -360 кДж/моль |
| Экспериментальная теплота гидрирования бензола | -209 кДж/моль |
| Энергия сопряжения бензола | -209 –(-360) = 151 кДж/моль |
Энергия сопряжения других ароматических соединений может быть определена таким же способом.
| Формула | Название соединения | Энергия сопряжения | Формула | Название соединения | Энергия сопряжения |
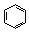
| Бензол | 151 | 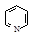
| Пиридин | 96 |
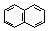
| Нафталин | 255 | 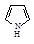
| Пиррол | 89 |
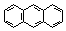
| Антрацен | 349 | 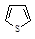
| Тиофен | 120 |
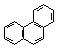
| Фенантрен | 382 | 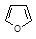
| Фуран | 66 |
В природе часто встречаются сопряженные системы. Чем длиннее сопряженная система, тем большее количество энергии выделяется при сопряжении, и в итоге получается более стабильная система.
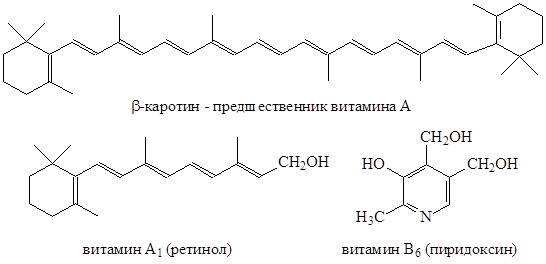
Примеры природных сопряженных систем
Ароматичность, критерии ароматичности
Среди циклических соединений с сопряженной системой двойных связей выделяют ароматические соединения, характеризующиеся повышенной термодинамической устойчивостью и особыми свойствами (низкая реакционная способность в реакциях присоединения, сравнительная легкость реакций замещения, сохраняющих сопряженную систему, устойчивость к окислению и другие). Соединение обладает ароматичностью, если:
- имеет плоский ци кл, все атомы которого находятся в состоянии sp2 - гибридизации;
- образуется сопряженная система p-электронов, охватывающая все атомы цикла;
- число электронов N(e), участвующих в сопряжении, удовлетворяет правилу Хюккеля: N(e) = 4n +2, где n = 0,1,2,3 и т.д.
Если не выполняется хотя бы один из этих критериев, то соединение не является ароматическим. Правило Хюккеля применимо к любым конденсированным системам, в которых нет атомов, являющихся общими более чем для двух циклов. Если число электронов N(e), участвующих в сопряжении, равно N(e) = 4n, такое соединение считается антиароматическим. Обычно такие соединения малоустойчивы.
Бензол является классическим представителем ароматических углеводородов, так как: имеет плоский цикл, все 6 атомов углерода находятся в состоянии sp2-гибридизации; образуется единая сопряженная система, охватывающая все атомы цикла (p,p-сопряжение); в сопряжении участвуют шесть электронов – по одному р-электрону от каждого атома углерода, что удовлетворяет правилу Хюккеля: 4n+2=6, n=1.
Нафталин, как и бензол, имеет плоский цикл, все 10 атомов углерода находятся в состоянии sp2-гибридизации, образуется сопряженная система, охватывающая все атомы цикла; в сопряжении участвуют 10 электронов (p,p-сопряжение) – по одному р-электрону от каждого атома углерода, что удовлетворяет правилу Хюккеля: 4n+2=10, n=2. Антрацен и фенантрен также удовлетворяют всем критериям ароматичности, в создании единой p,p-сопряженной системы в молекулах этих соединений участвуют 14 электронов.
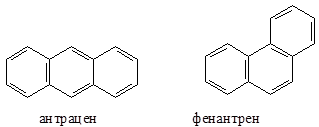
Эффект стабилизации присущ не только сопряженным шестичленным системам, но и трех-, четырех-, пяти-, семичленным системам, в которых число электронов, участвующих в сопряжении, удовлетворяет правилу Хюккеля. Такие соединения известны и подробно изучены. Они получили название небензоидных ароматических соединений.
Среди циклопропана и его производных ароматичным является только циклопропенил-катион, удовлетворяющий всем критериям ароматичности.
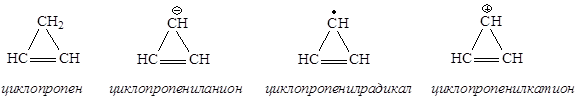
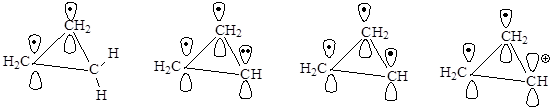
Циклопропен и его производные
Хотя все структуры являются плоскими, циклопропен относят к неароматическим соединениям (нет сопряженной системы), циклопропенил-радикал также является неароматическим соединением (в сопряжении 3 электрона), циклопропенил-анион относится к антиароматическим соединениям, так как в сопряжении участвуют 4 электрона. Циклопропенил-катион является ароматической системой, так как в результате сопряжения на трех атомах углерода делокализованы 2 электрона, т.е. N(e) = 4n+2=2, n = 0.
Циклобутадиен и циклооктатетраен являются антиароматическими соединениями, так как в сопряжении (p,p-сопряжение) участвуют, соответственно, 4 и 8 электронов, т.е N(e) = 4n, n=1; n=2). Циклопентадиен является неароматическим соединением, так как нет сопряженной системы, охватывающей все атомы цикла (один из атомов углерода в sp3-гибридизации).
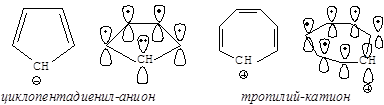
Но циклопентадиенил-анион и циклогептатриенил-катион – (катион тропилия) являются ароматическими системами, удовлетворяющими всем критериям ароматичности (все они имеют в сопряжении по 6 электронов).
Среди гетероциклических ненасыщенных соединений тоже есть соединения, удовлетворяющие критериям ароматичности. Типичными представителями пятичленных гетероциклических ароматических соединений являются фуран, тиофен, пиррол, имидазол.
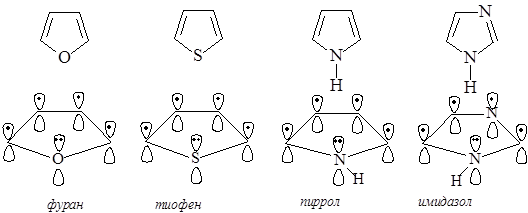
Примеры пятичленных гетероциклических ароматических соединений
Во всех молекулах в создании сопряженной системы участвуют 6 электронов и имеет место как p,p-сопряжение, так и р,p-сопряжение. p,p-сопряжение происходит в результате перекрывания р-орбиталей, участвующих в образовании p-связей, р,p-сопряжение – за счет дополнительного перекрывания р-орбитали гетероатома (с неподеленной парой р-электронов) и р-орбиталей атомов углерода, образующих p-связи.
Атом азота, предоставляющий для образования сопряженной системы пару р-электронов, называют пиррольным, атом азота, предоставляющий в сопряжение один р-электрон, называют пиридиновым атомом азота. Атомные орбитали пиррольного и пиридинового атомов азота находятся в состоянии sp2-гибридизации, но отличаются по своему электронному строению.
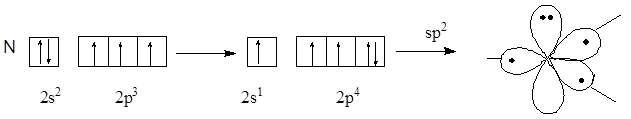
Электронное строение пиррольного атома азота
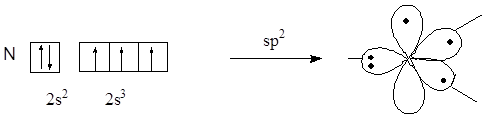
Электронное строение пиридинового атома азота
В сопряжение пиррольный атом азота предоставляет р-орбиталь с неподеленной парой электронов, а пиридиновый атом азота – р-орбиталь с неспаренным электроном, так как неподеленная пара электронов пиридинового атома азота расположена на гибридной орбитали.
Пиридин и пиримидин, являющиеся шестичленными гетероциклическими соединениями, также отвечают всем критериям ароматичности. В создании сопряженной системы в этих молекулах участвуют 6 электронов. Каждый атом, входящий в цикл, отдает в сопряжение по одному р-электрону. В этих соединениях, в отличие от пятичленных гетероциклов, имеет место только p,p-сопряжение, так как эти молекулы в своем составе содержат только пиридиновые атомы азота.

Примеры шестичленных гетероциклических ароматических соединений
Необходимо отметить разную устойчивость пиррола и пиридина в кислой среде. Пиррол в присутствии кислот подвергается полимеризации, так как в результате присоединения протона пиррольным атомом азота происходит разрушение сопряженной системы: 2р-электрона атома азота идут на образование связи с протоном по донорно-акцепторному механизму и ароматичность теряется. Пиридин, как и пиррол, также подвергается протонированию, но, в отличие от пиррола, пиридиновый цикл сохраняет ароматичность и устойчивость, так как для образования связи с протоном предоставляется пара электронов, расположенная на гибридной орбитали, которая в сопряжении не участвует.
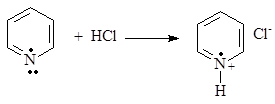
Пурин, являющийся структурной основой аденина и гуанина, также является гетероциклическим ароматическим соединением. Пурин представляет собой систему, состоящую из конденсированных пиримидинового и имидазольного циклов.
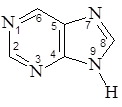
В пурине содержатся три пиридиновых атома азота (атомы под номерами 1,3,7) и один пиррольный (под номером 9), в создании сопряженной системы участвуют 10 электронов (4n+2=10, n=2). В молекуле имеет место как p,p-сопряжение, так и р,p-сопряжение.
Делокализация электронов (выравнивание электронной плотности) в результате сопряжения приводит к образованию более устойчивых систем, характеризующихся отличающейся реакционной способностью от той, которая ожидалась, исходя из структурной формулы соединения.
На реакционную способность молекул влияют также заместители, связанные с атомом углерода, которые за счет проявляемых ими электронных эффектов приводят к изменению полярности связей и их прочности. Различают два типа электронных эффектов заместителей: индуктивный и мезомерный.
Индуктивный эффект (I) – это передача электронного влияния заместителя по системе s -связей. Он возникает, если связь образована атомами, разными по электроотрицательности. Индуктивный эффект передается на небольшие расстояния (3 – 4 s -связи) и затухает. Графически обозначается стрелкой вдоль s – связи и показывает смещение электронной плотности к более электроотрицательному атому. Отрицательный индуктивный эффект (- I) – смещение электронной плотности по системе s – связей к заместителю. Его проявляют более электроотрицательные, чем углерод, атомы и группы атомов. Положительный индуктивный эффект (+ I) – смещение электронной плотности по системе s – связей от заместителя. Его проявляют углеводородные радикалы и анионы, связанные с атомом углерода. Принято считать, что индуктивный эффект атома водорода равен нулю, т.е. связь С-Н является неполярной ковалентной связью.
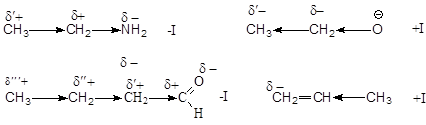
|
Дата добавления: 2013-12-12; Просмотров: 6375; Нарушение авторских прав?; Мы поможем в написании вашей работы!